
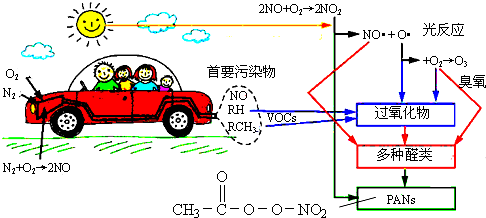
| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |
分析 A.燃油主要成分为碳氢化合物,不含有氮元素;
B.有机物是指含有碳元素的化合物,无机物是指不含有碳元素的化合物.一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物;
C.O3污染、硝酸型酸雨及雾霾都与汽车尾气排放有关;
D.温度越高,反应速率越快.
解答 解:A.汽车尾气中的NO来自于发动机工作产生的高温条件,空气中的氮气和氧气反应产生,不是来自于燃油,故A错误;
B.醛类、PANs(过氧乙酰硝酸酯)均属于含有碳元素的化合物,且性质和有机物相似,属于有机物,故B错误;
C.从图示可知,汽车排放的尾气,能引起O3污染、硝酸型酸雨及雾霾,故C错误;
D.汽车启动后,燃油燃烧产生高温,温度越高,N2与O2的反应速率越快,单位时间内NO排放量增大,故D正确;
故选D.
点评 本题考查汽车尾气的来源、危害,掌握氮及其化合物的性质以及常见大气污染物是解答关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| B. | 新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1 mol K2FeO4被还原 | |
| C. | 充电时阴极附近溶液的碱性增强 | |
| D. | 放电时正极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
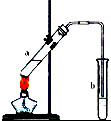 ①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
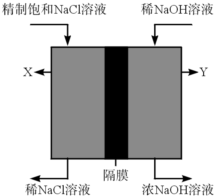 以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.
以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com