
【题目】25 ℃时,下列溶液的碱性最强的是
A. pH=11的溶液
B. 0.1 mol/L Ba(OH)2溶液
C. 1 L含有4 g NaOH的溶液
D. Kw/c(H+)=1.0×10-2的溶液
 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,反应4Fe(OH)2(s)+ 2 H2O(l)+ O2(g)═ 4 Fe(OH)3(s)能自发进行,则△ H<0
B. 有气体参与的可逆反应,在一定条件下达到平衡时,改变压强平衡一定发生移动
C. 化学平衡常数只与温度有关,与化学计量数无关
D. t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)NO(g)+SO3(g),通入少量O2,![]() 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
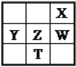
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为________。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是________(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 0.1 mol H2和0.1 mol I2在密闭容器中充分反应后,其分子总数等于0.2 NA
B. 向密闭容器中充入2 mol NO2一段时间后,容器中的分子数为2 NA
C. 1 L 0.1 mol/L H3PO4溶液中含H+数目为0.3 NA
D. 1 L 0.1 mol/L NH4Cl溶液中含有NH4+数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产钠和烧碱的原理如下:①电解熔融氯化钠制钠:2NaCl(熔融) ![]() 2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O
2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂
B.在反应①中氯气是还原产物,在反应②中氢气是还原产物
C.若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等
D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.NaOH加入NaHCO3溶液中:OH- + HCO![]() = H2O + CO
= H2O + CO![]()
B.少量CO2通入NaOH溶液中:2OH- + CO2= CO![]() + H2O
+ H2O
C.盐酸加入NaHCO3溶液中:H+ + HCO![]() = H2O + CO2↑
= H2O + CO2↑
D.金属钠与水反应:Na + H2O = Na+ + OH- + H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com