
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。

(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
【答案】 加快反应(或固体溶解)速率 防止H2O2分解 2.64×10-9 mol·L-1 +3 1︰6 Fe2O3 b NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑ 反应过程中产生的HCl能抑制NiCl2的水解
NiCl2+6SO2↑+12HCl↑ 反应过程中产生的HCl能抑制NiCl2的水解
【解析】试题分析:(1)根据影响反应速率的因素分析;(2)加热促进H2O2分解;“沉铁”后所得滤液的PH=4,根据![]() 计算“沉铁”后所得滤液中c(Fe3+);(3) ①根据化合价代数和等于0计算FeOOH中铁的化合价;②ClO3ˉ被还原为Clˉ,Fe2+被氧化为Fe3+;③根据上图,当T=120℃、pH=4时Fe元素的存在形式是Fe2O3;当T=120℃,PH=1~2.5时,Fe元素的存在形式是黄铁矾钠;(4)NiCl2·6H2O与SOCl2反应生成NiCl2、SO2、HCl;HCl能抑制NiCl2的水解;
计算“沉铁”后所得滤液中c(Fe3+);(3) ①根据化合价代数和等于0计算FeOOH中铁的化合价;②ClO3ˉ被还原为Clˉ,Fe2+被氧化为Fe3+;③根据上图,当T=120℃、pH=4时Fe元素的存在形式是Fe2O3;当T=120℃,PH=1~2.5时,Fe元素的存在形式是黄铁矾钠;(4)NiCl2·6H2O与SOCl2反应生成NiCl2、SO2、HCl;HCl能抑制NiCl2的水解;
解析:(1)“酸化”时将电镀废渣粉碎并适当加热,可以加快反应速率;(2) 加热促进H2O2分解,“氧化”时控制温度不超过40℃,可以防止H2O2分解;“沉铁”后所得滤液的PH=4,根据![]() , c(Fe3+)=
, c(Fe3+)=![]() 2.64×10-9 mol·L-1;(3) ①根据化合价代数和等于0,FeOOH中铁的化合价是+3;②ClO3ˉ被还原为Clˉ,Fe2+被氧化为Fe3+,根据得失电子守恒,氧化剂与还原剂物质的量之比是1︰6;③根据上图,当T=120℃、pH=4时Fe元素的存在形式是Fe2O3;当T=120℃,PH=1~2.5时,Fe元素的存在形式是黄铁矾钠,所以控制PH为1~2.5,故选b;(4)NiCl2·6H2O与SOCl2反应生成NiCl2、SO2、HCl,反应方程式是NiCl2·6H2O+6SOCl2
2.64×10-9 mol·L-1;(3) ①根据化合价代数和等于0,FeOOH中铁的化合价是+3;②ClO3ˉ被还原为Clˉ,Fe2+被氧化为Fe3+,根据得失电子守恒,氧化剂与还原剂物质的量之比是1︰6;③根据上图,当T=120℃、pH=4时Fe元素的存在形式是Fe2O3;当T=120℃,PH=1~2.5时,Fe元素的存在形式是黄铁矾钠,所以控制PH为1~2.5,故选b;(4)NiCl2·6H2O与SOCl2反应生成NiCl2、SO2、HCl,反应方程式是NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑;反应过程中产生的HCl能抑制NiCl2的水解,所以NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水。
NiCl2+6SO2↑+12HCl↑;反应过程中产生的HCl能抑制NiCl2的水解,所以NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700 -900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
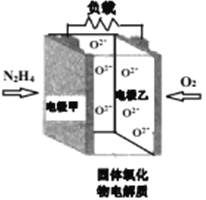
A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2= 2NO+2H2O
C. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4LO2参与反应
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体的原料,以硫酸工业的尾气为原料联合制备K2SO4和Mn3O4的工艺流程如图所示。回答下列问题:

(1)Mn3O4中的Mn元素有+2价和+3价两种情况,则 Mn3O4中+2价与+3价Mn 元素的物质的量之比为__________________________。
(2)“反应I”________(填“是”或“不是”)氧化还原反应,为提高反应的反应速率,可采取的措施有____________________________(答出一条即可)。
(3)“反应II”的反应原理是___________________________。
(4)试剂a的电子式为_________________________。
(5)“一系列操作”指____________________,该过程用到的非玻璃仪器为_______________。
(6)流程图中“煅烧”操作的温度与剩余固体质量变化曲线如图所示。

则产物A的化学式为______________,产物B的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在加热下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( )
①两块钠失去电子一样多 ②第一块钠失去电子多 ③第二块钠失去电子多
④两块钠的反应产物质量一样大 ⑤第一块钠的反应产物质量大
⑥第二块钠的反应产物质量大
A. ①④ B. ②⑤ C. ③⑥ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1= 180.5kJ·mol1
C(s) + O2(g) = CO2(g) ΔH2 = 393.5kJ·mol1
2C(s) + O2(g) =2CO(g) ΔH3 =221.0kJ·mol1
(1)某反应的平衡常数表达式为K=![]() , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:

用离子方程式表示Na2S2O3溶液具有碱性的原因___________。Na2S2O3与氯水反应的离子方程式是__________。
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为_________________________(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

(5)2SO3(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com