
| A. | 乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应 | |
| B. | 将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应 | |
| C. | 乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应 |
分析 A.乙醇含有羟基,可被酸性高锰酸钾氧化;
B.苯与溴水不反应;
C.乙烯含有碳碳双键,可与溴发生加成反应;
D.己烷为饱和烃,可发生取代反应.
解答 解:A.乙醇含有羟基,可被酸性高锰酸钾氧化,可被高锰酸钾氧化为乙酸,故A正确;
B.苯与溴水不反应,可与液溴在催化剂条件下发生取代反应,因溴易溶于苯,可萃取溴,但没有反应,故B错误;
C.乙烯含有碳碳双键,可与溴发生加成反应,故C正确;
D.己烷为饱和烃,可发生取代反应,与氯气在光照条件下发生取代反应,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,把握有机物官能团与性质、反应类型及反应条件等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |  |
| A | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
| C | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
| D | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

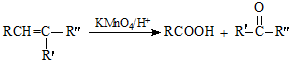
 +
+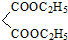 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$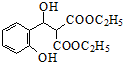 $\stackrel{△}{→}$
$\stackrel{△}{→}$
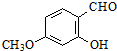 .
.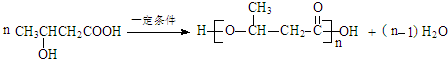 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
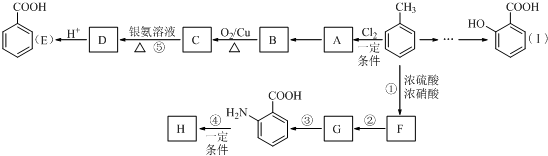
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
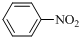 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$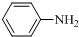 (苯胺,易被氧气氧化)
(苯胺,易被氧气氧化) .
.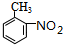 .写出③的转化关系
.写出③的转化关系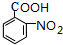 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (用已知中的表达方式表示,不用写化学方程式).
(用已知中的表达方式表示,不用写化学方程式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH,原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
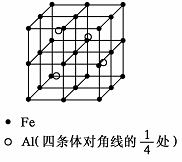 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作及现象 | 结 论 |
| A | 将0.1mol•L-1 Na2CO3溶液稀释到0.01mol•L-1,测得pH变小 | 稀释后CO32-的水解程度减小 |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 向溴水中加入少量苯,振荡静置后水层为无色 | 苯与Br2发生了加成反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com