
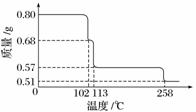
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
答案 (1)CuSO4·H2O
CuSO4·5H2O CuSO4·(5-n)H2O+nH2O
CuSO4·(5-n)H2O+nH2O
250 18n
0.80 g0.80 g-0.57 g=0.23 g
可列式: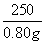 =
= ,求得n≈4。200 ℃时产物为CuSO4·H2O 晶体。
,求得n≈4。200 ℃时产物为CuSO4·H2O 晶体。
(2)CuSO4 CuO+SO3↑ CuSO4·5H2O 102 ℃
CuO+SO3↑ CuSO4·5H2O 102 ℃
解析 (1)分析CuSO4·5H2O受热脱水过程的热重曲线可知,200 ℃时和113 ℃时的产物相同,可根据113 ℃时样品质量确定脱水产物,设113 ℃时产物为CuSO4·(5-n)H2O,则有
CuSO4·5H2O CuSO4·(5-n)H2O+nH2O
CuSO4·(5-n)H2O+nH2O
250 18n
0.80 g0.80 g-0.57 g=0.23 g
可列式: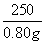 =
= ,求得n≈4。200 ℃时产物为CuSO4·H2O晶体。
,求得n≈4。200 ℃时产物为CuSO4·H2O晶体。
(2)根据灼烧产物是黑色粉末可知分解生成CuO,则具有氧化性的另一产物为SO3,所以灼烧时反应方程式为CuSO4 CuO+SO3↑,CuO溶于稀硫酸得CuSO4溶液,结晶时又生成CuSO4·5H2O,由脱水过程的热重曲线可知其存在的最高温度为102 ℃。
CuO+SO3↑,CuO溶于稀硫酸得CuSO4溶液,结晶时又生成CuSO4·5H2O,由脱水过程的热重曲线可知其存在的最高温度为102 ℃。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
己烯雌酚是人工合成的激素类药物,其结构如下。下列有关叙述不正确的是( )
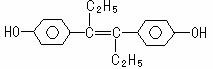
A.己烯雌酚的分子式为C18H20O2
B.己烯雌酚可与NaOH和NaHCO3发生反应
C.1 mol该有机物可以与5 mol Br2发生反应
D.该有机物最多可能有18个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO- + H3O+ B. HS- + H2O
HCOO- + H3O+ B. HS- + H2O S2- + H3O+
S2- + H3O+
C.CO32- + H2O HCO3- + OH- D.HCO3-+H2O
HCO3- + OH- D.HCO3-+H2O CO3 2- + H3O+
CO3 2- + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
 对于一定条件下的可逆反应2N2O5(g) 4NO2(g) + O2(g) △H>0,在一定条件下达到平衡状态后,若改变条件(未说明的条件不变),对有关物理量及平衡状态有何影响?将变化结果(填增大、减小、不变、变深、变浅),填入空格。
对于一定条件下的可逆反应2N2O5(g) 4NO2(g) + O2(g) △H>0,在一定条件下达到平衡状态后,若改变条件(未说明的条件不变),对有关物理量及平衡状态有何影响?将变化结果(填增大、减小、不变、变深、变浅),填入空格。
(1)压强不变,充入少量氦气,混合气体的颜色 。
(2)升高体系的温度,混合气体的平均相对分子质量 。
(3)使用正催化剂,正反应速率 ,逆反应速率 ,N2O5的转化率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。

①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2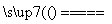 1________+3________。
1________+3________。
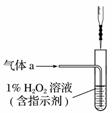
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
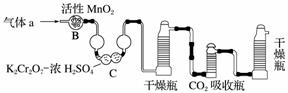
①气体a通过B和C的目的是______________________________________。
②计算钢样中碳的质量分数,应测量的数据是________________________________________________________________________
________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 确定硫的质量:
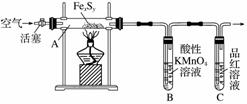
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管 B中加入50 mL 0.100 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至 250 mL 容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)溶液滴定剩余的 KMnO4。记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO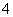 +2H2O+5SO2===2Mn2++5SO
+2H2O+5SO2===2Mn2++5SO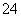 +4H+
+4H+
②2MnO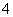 +6H++5H2C2O4===2Mn2++10CO2↑+8H2O
+6H++5H2C2O4===2Mn2++10CO2↑+8H2O
【实验Ⅱ】 确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)判断滴定终点的方法是____________________。
(2)试管C中品红溶液的作用是__________________________________________。
有同学提出,撤去C装置对实验没有影响,你的看法是________(选填“同意”或“不同意”),理由是____________________________。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为____________________。
【问题探究】 滴定过程中,细心的同学发现该KMnO4溶液颜色褪去的速率较平常滴定时要快得多。为研究速率加快的原因,该同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(4)分析上述数据,滴定过程中反应速率加快的一种可能原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述中正确的是 ( )
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C>D>B>A
D.单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃,101 k Pa下,0.2 mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92 kJ热量。表示上述反应的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) △H=+259.92 kJ/mol
B.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-259.92 kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+2599.2 kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com