
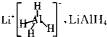 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )| A、释放出H2的厦应都是放热反应 |
| B、LiAIH4中含有离子键、共价键 |
| C、LiAIH4与乙醛作用生成乙醇,LiAIH4作氧化剂 |
| D、LiAIH4在125℃分解,每转移2mol电子放出2.24L的H2 |
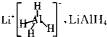 结构容易得出LiAlH4中含有离子键、共价键;
结构容易得出LiAlH4中含有离子键、共价键;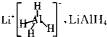 结构容易得出LiAlH4中含有锂离子的离子键和铝与氢之间共价键;故B正确;
结构容易得出LiAlH4中含有锂离子的离子键和铝与氢之间共价键;故B正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在溶液甲中滴加用盐酸酸化的,有白色沉淀 |
| B、在溶液甲中滴加Ba(NO3)2溶液,有白色沉淀 |
| C、在溶液甲中先滴加硝酸酸化,后滴加Ba(NO3)2溶液,有白色沉淀 |
| D、在溶液甲中先滴加盐酸酸化,没有白色沉淀,后滴加BaCl2溶液,有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t 0C | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeI2溶液中通入足量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目3NA | ||
| B、1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 | ||
| C、在反应KIO3+6HI=3I2+KI+3H2O中,每生成1mol I2转移电子数为2NA | ||
D、CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水鉴别1-丙醇、甲苯和硝基苯 |
| B、用燃烧法鉴别甲醇、苯和四氯化碳 |
| C、用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D、用溴水鉴别乙苯、苯酚、环己烷和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、KCl |
| C、ZnCl2 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
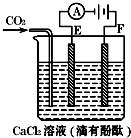
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com