
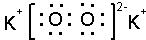 ;
;分析 V、W、X、Y、Z五种元素,它们的原子序数依次增大,且都小于20.
V和Z属同一族,它们原子的最外电子层上只有1个电子,则属于第IA族元素,V为非金属元素,则V为H元素;
W和Y也属同一族,W原子最外电子层上的电子数是次外电子层上电子数的3倍,最外层电子数不超过8个,则W为O元素,Y为S元素;
X原子最外电子层上电子数等于Y原子最外电子层上电子数的一半,最外层电子数为3,且原子序数大于W,所以为Al元素;
Z是金属元素且原子序数大于S元素,则Z为K元素;
(1)Al、K各自的最高价氧化物对应的水化物分别是Al(OH)3、KOH,二者反应生成偏铝酸钾和水;
(2)X最高价氧化物对应的水化物Al(OH)3在水中能发生酸式电离和碱式电离,酸式电离生成氢离子、偏铝酸根离子和水,碱式电离生成铝离子和氢氧根离子;
(3)O与K可形成化合物K2O2,该化合物为离子化合物,钾离子和过氧根离子之间存在离子键、O-O原子之间存在共价键;
(4)S与K形成的化合物为K2S,K2S为强碱弱酸盐,硫离子水解导致溶液呈碱性;
(5)标准状况下,S的最高价氧化物SO3为无色晶体,该条件下0.25mol该物质与一定量液态水混合得到一种稀溶液,并放出Q kJ的热量,则1mol该物质和水反应生成放出4QkJ热量,据此书写热化学方程式;
(6)V2W2为H2O2,用短线代替所有的共用电子对即为结构式.
解答 解:V、W、X、Y、Z五种元素,它们的原子序数依次增大,且都小于20.
V和Z属同一族,它们原子的最外电子层上只有1个电子,则属于第IA族元素,V为非金属元素,则V为H元素;
W和Y也属同一族,W原子最外电子层上的电子数是次外电子层上电子数的3倍,最外层电子数不超过8个,则W为O元素,Y为S元素;
X原子最外电子层上电子数等于Y原子最外电子层上电子数的一半,最外层电子数为3,且原子序数大于W,所以为Al元素;
Z是金属元素且原子序数大于S元素,则Z为K元素;
(1)Al、K各自的最高价氧化物对应的水化物分别是Al(OH)3、KOH,二者反应生成偏铝酸钾和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)X最高价氧化物对应的水化物Al(OH)3在水中能发生酸式电离和碱式电离,酸式电离生成氢离子、偏铝酸根离子和水,碱式电离生成铝离子和氢氧根离子,电离方程式为H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(3)O与K可形成化合物K2O2,该化合物为离子化合物,钾离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,电子式为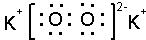 ,故答案为:
,故答案为: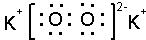 ;
;
(4)S与K形成的化合物为K2S,K2S为强碱弱酸盐,硫离子水解导致溶液呈碱性,则pH>7,水解离子方程式为S2-+H2O?HS-+OH-,
故答案为:>;S2-+H2O?HS-+OH-;
(5)标准状况下,S的最高价氧化物SO3为无色晶体,该条件下0.2mol该物质与一定量液态水混合得到一种稀溶液,并放出Q kJ的热量,则1mol该物质和水反应生成放出5QkJ热量,其热化学方程式为:SO3(s)+H2O(l)=H2SO4(aq)△H=-5Q kJ•mol-1,
故答案为:SO3(s)+H2O(l)=H2SO4(aq)△H=-5Q kJ•mol-1;
(6)V2W2为H2O2,为共价化合物,其结构式为:H-O-O-H,
故答案为:H-O-O-H.
点评 本题考查位置结构性质相互关系及应用,涉及盐类水解、热化学方程式、电子式、弱电解质的电离等知识点,综合性较强,难点是氢氧化铝电离方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .用电子式表示D2C的形成过程
.用电子式表示D2C的形成过程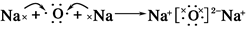 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| 浓度(mol•L-1) | 0.085 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
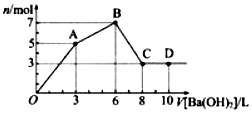 向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在形式是AlO2- | |
| B. | 向D点溶液中通入CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c(Al2(SO4)3):c(AlCl3)=2:l | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C3H8 | B. | C5H10和C6H6 | C. | C2H6O和C2H4O2 | D. | C3H6和C3H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3极易溶于水,可用于工业制冷剂 | |
| B. | HNO3具有酸性,可用于制备硝酸盐原料 | |
| C. | NH4 NO3易溶于水,可用于制造高温材料 | |
| D. | N2难溶于水,可用于合成氨原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z不可能全为非金属元素 | |
| B. | W的简单气态氢化物的沸点一定高于Z的简单气态氢化物的沸点 | |
| C. | 若W、X、Y的原子序数依次相差2,则在工业上制备Y的单质时,W、X、Y形成的化合物起到了重要作用 | |
| D. | 若W与X的原子序数相差4,则Z与X形成的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com