
| A. | 镁、干冰、硫酸、纯碱、食盐 | B. | 碘酒、冰、盐酸、烧碱、硫酸钡 | ||
| C. | 氢气、氧化钠、硝酸、烧碱、氯化铜 | D. | 铁、氧化铜、醋酸、石灰水、硝酸钾 |
分析 单质:由同种元素组成的纯净物叫单质;
氧化物:由两种元素组成,其中一种是氧元素;
酸:在水溶液中,电离出的阳离子全部是氢离子的化合物称为酸;
碱:在水溶液中,电离出的阴离子全部是氢氧根离子的化合物称为碱;
盐:由金属阳离子(或铵根)和酸根阴离子形成的一类化合物.
解答 解:A.镁、干冰、硫酸、纯碱、食盐分别是单质、氧化物、酸、盐、盐,故A错误;
B.碘酒、冰、盐酸、烧碱、硫酸钡分别是混合物、氧化物、混合物、碱、盐,故B错误;
C.氢气、氧化钠、硝酸、烧碱、氯化铜分别是单质、氧化物、酸、碱、盐,故C正确;
D.铁、氧化铜、醋酸、石灰水、硝酸钾分别是单质、氧化物、酸、混合物、盐,故D错误;
故选:C.
点评 本题考查了物质的分类,熟悉单质、氧化物、酸、碱、盐的概念是解题关键,侧重考查学生对基础知识的掌握的熟练程度.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中HCl的物质的量 | B. | 溶液的浓度 | ||
| C. | 溶液中Cl-的数目 | D. | 溶液的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
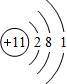 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、SO42-、NO3- | B. | K+、Ca2+、NO3-、CO32- | ||
| C. | Na+、K+、HCO3-、NO3- | D. | K+、MnO4-、NH4+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于如图所示的原电池,下列说法不正确的是( )
关于如图所示的原电池,下列说法不正确的是( )| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 该装置将化学能转化为电能 | D. | 电子由铜片经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 2:1 | C. | 4:1 | D. | 11:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com