
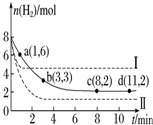
 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |
分析 该反应在8~10min内,H2的物质的量在对应的c、d点都是2mol,v(H2)=$\frac{2mol-2mol}{2L×2min}$=0,v(CO2)=$\frac{1}{3}×$v(H2).
解答 解:由图可知,该反应在8~10min内,H2的物质的量在对应的c、d点都是2mol,因此v(H2)=$\frac{2mol-2mol}{2L×2min}$=0mol•L-1•min-1,
根据化学反应速率之比等于化学计量数之比,v(CO2)=$\frac{1}{3}×$v(H2)=0mol•L-1•min-1,
故选C.
点评 本题考查了化学反应速率的定量表示方法,难度不大,根据图中数据带入v=$\frac{△n}{V•△t}$计算、化学反应速率之比等于化学计量数之比即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ | |
| D. | 电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一项 | B. | 二项 | C. | 三项 | D. | 四项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 将氯水长期放置,黄绿色消失 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com