
(6分)将一定量的碳酸钠和碳酸氢钠的混合物27.4 g ,跟含溶质0.4mol 的盐酸恰好反应,生成二氧化碳气体。
(已知碳酸氢钠和盐酸反应的方程式如下:NaHCO3+HCl→NaCl+CO2↑+H2O )
(1)写出碳酸钠与盐酸反应的化学方程式
(2)求原混合物中碳酸钠和碳酸氢钠的质量各多少克?
(3)求生成的二氧化碳气体在标准状况下的体积。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出以上叙述中涉及的化学方程式:
①________________________________ ;?
②________________________________ ;?
③________________________________ ;?
④________________________________ 。?
(2)制取甲硅烷的装置与制取_______(填“H2”或“O2”)的装置相似。?
(3)加入稀盐酸之前后应向密闭装置中通入氮气一会儿,其目的是________________________。
(4)为研究甲硅烷的化学性质,进行了如下实验:?
①将甲硅烷通入少量的硝酸银溶液中,发现有沉淀生成,后经测定知该沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀。向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。将甲硅烷通入硝酸银溶液中发生反应的化学方程式为________________。?
②制取甲硅烷后,检验装置中是否有残留的甲硅烷的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出以上叙述中涉及的化学方程式:
①____________________________________________________________
②____________________________________________________________
③____________________________________________________________
④____________________________________________________________。
(2)制取甲硅烷的装置与制取__________ (填“H
(3)加入稀盐酸之前后应向密闭装置中通入氮气一会儿,其目的是__________。
(4)为研究甲硅烷的化学性质,进行了如下实验:
①将甲硅烷通入少量的硝酸银溶液中,发现有沉淀生成,后经测定知该沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀。向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。将甲硅烷通入硝酸银溶液中发生反应的化学方程式为___________________________________________________________________。
②制取甲硅烷后,检验装置中是否有残留的的甲硅烷的方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)写出上述内容涉及的化学方程式。
(2)制取甲硅烷的装置与制取________(填“氧气”“氢气”或“氯气”)的装置相似。
(3)加入稀盐酸之前应向密闭装置中通入一会儿氮气,其目的是______________。
(4)收集甲硅烷气体只能采用________法,这是因为________。收集完甲硅烷气体后不能直接将导气管从水槽中取出,这是为了防止________,正确的操作方法是________________。
(5)为了研究甲硅烷的化学性质,进行如下实验:①将甲硅烷通入少量的高锰酸钾酸性溶液中,发现有二氧化锰生成,同时还生成了所有气体中最轻的气体,然后经测定得知所得溶液为无色的硅酸钾(K2SiO3)溶液,该反应的化学方程式为_______________________。②将甲硅烷通入少量的硝酸银溶液,发现有沉淀生成,然后经测定得知沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀生成;向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。则将甲硅烷通入硝酸银溶液中,发生反应的化学方程式为____________________________________。
(6)制完甲硅烷后,检验装置中是否有残留的甲硅烷的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省宁德市高二上学期质量检测化学试卷A(解析版) 题型:实验题
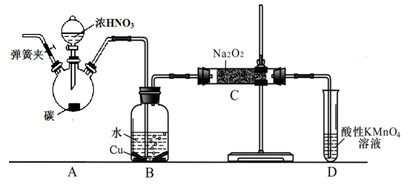
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
|
滴定次数 |
1 |
2 |
3 |
4 |
|
KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com