
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g); ![]() 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
【答案】B
【解析】试题A.这三个反应是在恒温、恒容条件下进行,达到平衡时是等效平衡,由于加入的物质开始不完全相同,所以达到平衡时反应放出的热量不等,而且该反应是可逆反应,不能完全转化,所以三者的关系是A.197 kJ >Q1>Q2=Q3,错误;B.由于物质在气态时含有的能量比固态时高,所以若在上述条件下反应生成2molSO3(s)的反应放出的热量大于197 kJ,因此反应热为△H1,则△H1<-197 kJ/mol,正确; C.化学平衡常数只与温度有关,由于甲、乙、丙3个容器中反应的温度相同,所以平衡常数相等,错误; D.该反应是反应前后气体体积不等的反应,由于达到平衡时是等效平衡,所以平衡时任何反应气体的物质的量相等,在丙中含有惰性气体,所以丙容器中SO2的体积分数最小,错误。


科目:高中化学 来源: 题型:
【题目】如果把![]() 的相对原子质量定义为24,以
的相对原子质量定义为24,以![]() 所含的C原子数为阿伏加德罗常数,则在标准状况时下列数值肯定不变的是( )
所含的C原子数为阿伏加德罗常数,则在标准状况时下列数值肯定不变的是( )
A.浓硫酸(![]() )的物质的量浓度
)的物质的量浓度
B.常温下氯化钠的溶解度
C.标准状况下气体摩尔体积.
D.1克拉钻石所含的C原子的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:
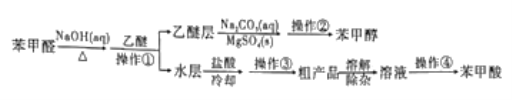
相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
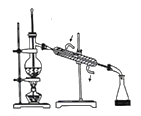
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
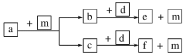
A.原子半径:W<X<Y<Z
B.阴离子的还原性:Y>W
C.图中物质的转化过程均为氧化还原反应
D.a一定只由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 加压,平衡右移,化学平衡常数增大
B. 此时,B的平衡转化率是40%
C. 该反应的化学平衡常数表达式是K=![]()
D. 增加C,B的平衡转化率变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都为短周期元素,A 原子失去一个电子后成为一个质子;C 的-1 价阴离子与氖原子具有相同的电子层结构;D在C 的下一周期,D可与同周期的B形成 BD2型离子化含物;E 和 C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是____________。
(2)A与 E 形成的最简单化合物的电子式为____________。
(3)C的氢化物与 D的氢化物的沸点相比较: ____________(用化学式表示,且用>符号连接)。 解释原因______________。
(4)E 的氢化物与 E 的最高价氧化物对应水化物反应的生成物中含有的的化学键有____________。
(5)E 的最高价氧化物对应的水化物的稀溶液与过量铁粉发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在元素周期表中的相对位置如表所示,已知A原子最外层电子数与次外层电子数之比为2:1。E和C、D同周期,它的原子序数比B多6。
回答下列问题:
A | B | ||
C | D |
(1)人的汗液中含有D的简单离子,其离子结构示意图为______,元素C在元素周期表中的位置是______。C的最高价氧化物的水化物的浓溶液稀释的方法是______。
(2)A的最高价氧化物的化学式为_____,所含的化学键类型是______(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应的水化物的化学式为____,它是______(填“酸性”或“两性”或“碱性”)化合物。写出该化合物与氢氧化钠溶液反应的离子方程式______。
(4)加热时,B的最高价氧化物对应水合物的浓溶液与单质A反应的化学方程式为(用具体的化学式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。

下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是
A. 磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
B. FeBr2中通入氯气使一半的Br氧化:2Fe2++2Br+ 2Cl2=2Fe3++Br2+4Cl
C. NH4Al(SO4)2溶液中加入过量的Ba(OH)2:NH4++Al3++2SO42-+2Ba2++4OH=NH3·H2O+AlO2-+2BaSO4↓+H2O
D. 饱和FeCl3溶液滴入沸水制氢氧化铁胶体:Fe3++3H2O(沸水)![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com