
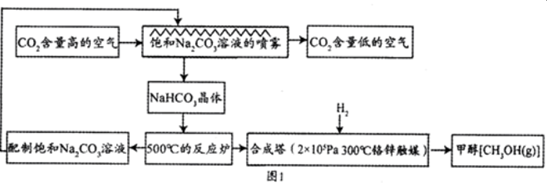
| nA |
| tA |
| n(H2) |
| n(CH3OH) |
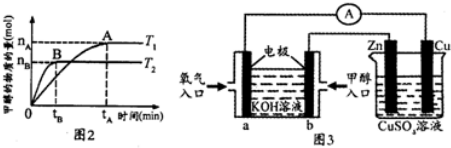
| △c |
| △t |
| ||
| ||
| △c |
| △t |
| n(H2) |
| n(CH3OH) |
| 19.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、Ag+、Ca2+、Cl-、SO42- |
| B、Fe2+、H+、SO32-、ClO- |
| C、Mg2+、NH4+、Cl-、SO42- |
| D、K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
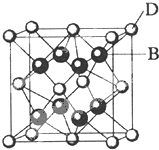 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCOOH+H2O═HCOO-+H3O+ |
| B、CO2+H2O═HCO3-+H+ |
| C、CO32-+H2O═HCO3-+OH- |
| D、HS-═S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素名称 | 氟 | 氧 | 溴 | 碘 | 铍 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
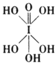 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6查看答案和解析>>
科目:高中化学 来源: 题型:
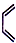 ;
;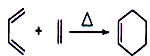
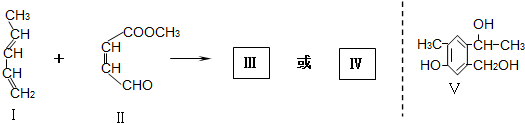
| Br2/CCl4 |
| ① |

| NaOH/醇溶液,△ |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将31g Na2O溶于1升水中 |
| B、常温下,将22.4升HCl溶于水中,形成1升溶液 |
| C、将100mL5mol/L的KNO3溶液加水称释至500mL |
| D、将10mL10mol/L的H2SO4溶液与90mL水混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com