
 反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图所示.回答下列问题:
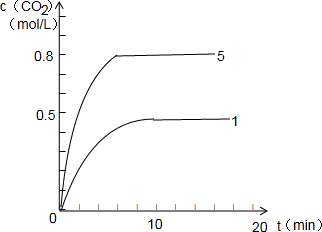
反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图所示.回答下列问题:| 组别 | 温度(℃) | 起始浓度(mol/L) | 反应达平衡时所需时间(min) | 平衡浓度(mol/L) c(CO2)或c(H2) | |
| c(CO) | c(H2O) | ||||
| Ⅰ | 800 | 1.00 | 1.00 | 10 | 0.50 |
| Ⅱ | 800 | 1.00 | 4.00 | t2 | c2 |
| Ⅲ | 800 | 1.00 | 1.00 | 1 | 0.50 |
| Ⅳ | 1000 | 1.00 | 1.00 | 8 | 0.40 |
| Ⅴ | 1000 | 2.00 | 2.00 | t5 | c5 |

| △c(CO) |
| △t |
| 0.5mol?L-1 |
| 10min |
| x?x |
| (1-x)?(4-x) |
 ,故答案为:
,故答案为: ;
;| 1.0×3.0 |
| 1.0x |


科目:高中化学 来源: 题型:
| A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合HCO3-+Ba2++OH-═BaCO3↓+H2O |
| B、向小苏打溶液中加入醋酸溶液:HCO3-+H+═CO2↑+H2O |
| C、氯化铁溶液中加入铜片:Fe3++Cu═Fe2++Cu2+ |
| D、NaHCO3的水解:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16g CH4所含原子数目为NA |
| B、1mol?L NaCl溶液含有NA个Na+ |
| C、常温常压下,22.4L CO2中含有NA个CO2分子 |
| D、2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一定条件下,xA+yB?zC,达到平衡,试填写下列空白:
(1)在一定条件下,xA+yB?zC,达到平衡,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na在空气中燃烧,发出蓝光 |
| B、Na在空气中燃烧,产物是Na2O |
| C、Na是银白色金属,硬度大,熔点高 |
| D、大量的钠着火时可以用沙子扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com