
分析 (1)欲配制480mL0.01mol/L 酸性KMnO4标准溶液,应选择500mL容量瓶,配制500ml 0.01mol/L 酸性KMnO4标准溶液,溶液中KMnO4的物质的量为:0.5L×0.01mol•L-1=0.005mol,则KMnO4的质量为:0.005mol×158g/mol=0.79g;
(2)滴定时KMnO4溶液氧化H2C2O4溶液生成二氧化碳和锰离子,根据氧化还原反应得失电子守恒书写离子方程式;
(3)滴定过程中用KMnO4标准溶液进行滴定,根据KMnO4标准溶液具有强氧化性选择滴定管;根据KMnO4标准溶液本身就是一种指示剂判断滴定终点的现象;
(4)利用关系式法计算H2C2O4的物质的量浓度来分析;滴定过程中若开始时滴定管有气泡滴定后气泡消失,说明消耗KMnO4标准溶液偏大,据此分析.
解答 解:(1)欲配制480mL0.01mol/L 酸性KMnO4标准溶液,应选择500mL容量瓶,配制500ml 0.01mol/L 酸性KMnO4标准溶液,溶液中KMnO4的物质的量为0.5L×0.01mol•L-1=0.005mol,则KMnO4的质量为0.005mol×158g/mol=0.79g,由托盘天平称量的精确度为0.1g,所以需称取KMnO4的质量为0.8g,故答案为:500;0.8;
(2)滴定时KMnO4溶液氧化H2C2O4溶液生成二氧化碳和锰离子,根据氧化还原反应得失电子守恒,则发生的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(3)滴定过程中用KMnO4标准溶液进行滴定,因为KMnO4标准溶液具有强氧化性,所以选择酸式滴定管;因KMnO4标准溶液本身就是一种指示剂,滴入最后一滴溶液变为紫色,且在半分钟内不褪色;
故答案为:酸式;当滴下最后一滴KMnO4标准溶液时,溶液颜色变为紫红色,且在半分钟内不褪色;
(4)由2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,
5H2C2O4~~~~2MnO4-
7.5×10-4mol 0.01mol•L-1×0.03L
H2C2O4的物质的量浓度为 $\frac{7.5×10{\;}^{-4}mol}{0.02L}$=3.75×10-2mol/L,
滴定过程中若开始时滴定管有气泡滴定后气泡消失,说明消耗KMnO4标准溶液偏大,则所测得H2C2O4溶液浓度偏大,
故答案为:3.75×10-2mol/L;偏大.
点评 本题考查了滴定法测定未知溶液浓度的实验方法,涉及溶液的配制,滴定实验的终点判断,滴定过程的计算应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O 酯化反应 | |
| C. | 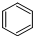 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$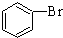 +HBr 加成反应 +HBr 加成反应 | |
| D. | 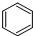 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$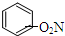 +H2O 取代反应 +H2O 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
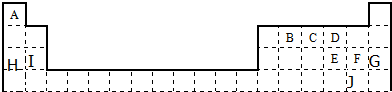
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
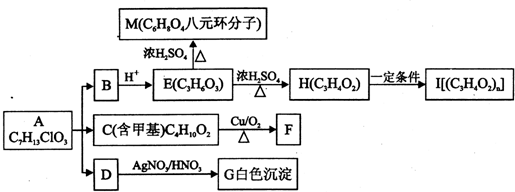
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$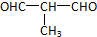 +2H2O.
+2H2O.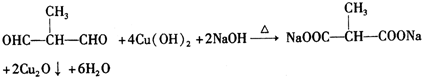 .
.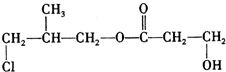
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com