
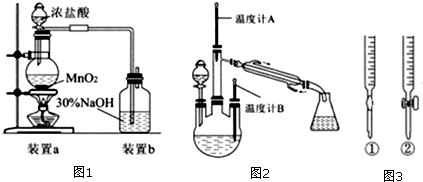
分析 (1)二氧化锰与浓盐酸反应生成氯化锰、氯气与水;
(2)利用氯气与氢氧化钠反应制备NaClO,反应也生成氯化钠,不会引入杂质;
(3)NaClO过量会将水合肼氧化;生成水合肼 (N2H4•H2O) 进行蒸馏分离,收集108~ll4℃馏分;
(4)碘水具有强氧化性,能腐蚀碱式滴定管的橡胶;
(5)N2H4•H2O具有极强的还原性,易被氧化成N2,碘水具有强氧化性,被还原生成HI;
(6)由N2H4•H2O+2I2=N2+4HI+H2O可知水合肼的物质的量,进而计算其质量分数.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2+Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2+Cl2↑+2H2O;
(2)利用氯气与氢氧化钠反应制备NaClO,发生反应:Cl2+2NaOH=NaClO+NaCl+H2O,反应生成NaCl,不会引入杂质,故该同学的说法不正确,
故答案为:不正确,因为Cl2+2NaOH=NaClO+NaCl+H2O,反应生成NaCl,不会引入杂质;
(3)采用“缓慢滴入”,防止NaClO过量将水合肼氧化;生成水合肼 (N2H4•H2O) 进行蒸馏分离,收集108~ll4℃馏分,温度计A的温度控制范围为 108~ll4℃,
故答案为:防止NaClO过量将水合肼氧化;108~ll4℃;
(4)碘单质具有氧化性,能腐蚀碱式滴定管的橡胶,则碘水应装在酸式滴定管中,
故答案为:②;
(5)N2H4•H2O具有极强的还原性,易被氧化成N2,碘水具有强氧化性,被还原生成HI,反应方程式为:N2H4•H2O+2I2=N2+4HI+H2O,
故答案为:N2H4•H2O+2I2=N2+4HI+H2O;
(6)由N2H4•H2O+2I2=N2+4HI+H2O,可知100ml溶液中含有水合肼的物质的量=0.200mol/L×0.018L×$\frac{1}{2}$×$\frac{100mL}{10mL}$=0.018mol,
水合肼(N2H4•H2O)的质量分数=$\frac{0.018mol×50g/mol}{5g}$×100%=18.00%,
故答案为:18.00%.
点评 本题考查物质制备实验,涉及物质含量测定、对操作的分析评价、滴定应用等,注意根据题目信息确定溶液添加顺序,较好的考查学生对实验原理的理解、知识迁移应用,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲苯(
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(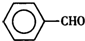 )、苯甲酸(
)、苯甲酸( )等
)等| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
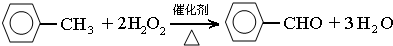 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
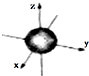
| A. | 3d3表示3d能级上有3个轨道 | |
| B. | ns能级的原子轨道图都可以用右图表示 | |
| C. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| D. | 电子云图的黑点密度越大,说明核外空间电子数越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com