


| △c |
| △t |
| △c |
| △t |
| ||
| 2min |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
 ,它的分子式是
,它的分子式是查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无味的气体,F为红棕色气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无味的气体,F为红棕色气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
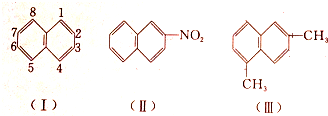
| A、2,6-二甲基萘 |
| B、1,4-二甲基萘 |
| C、4,7-二甲基萘 |
| D、1,6-二甲基萘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、治理“地沟油”,可通过水解反应制得肥皂 |
| B、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
| C、变质的植物油有难闻的气味,是因为植物油发生了水解反应 |
| D、绿色化学的核心是对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com