
 ,C为SiO2,Si原子成4个σ价,没有孤对电子,Si原子采取sp3杂化,故答案为:
,C为SiO2,Si原子成4个σ价,没有孤对电子,Si原子采取sp3杂化,故答案为: ;sp3杂化;
;sp3杂化;

科目:高中化学 来源: 题型:
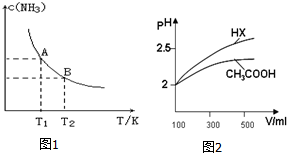 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
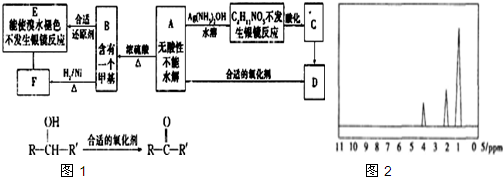
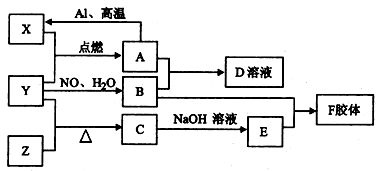
查看答案和解析>>
科目:高中化学 来源: 题型:
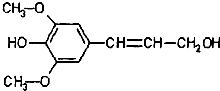
| A、分子式是C11H14O4,属于芳香烃 |
| B、分子中所有碳原子不可能在同一平面 |
| C、不能与Na反应放出H2 |
| D、能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
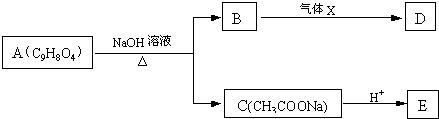
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在自来水中加入大量液氯进行消毒 |
| B、加入大量的明矾使浑浊的水变为澄清的水 |
| C、钢铁厂用适量熟石灰[Ca(OH)2]处理酸性废水 |
| D、加入适量S2-处理Hg2+(汞离子)污染的废水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3.H2O |
| B、NaOH |
| C、Na2CO3 |
| D、MgCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com