
| A. | 能够完全电离的电解质称为强电解质,如硫酸、盐酸、氢氧化钠等是强电解质 | |
| B. | 1mol甲烷燃烧放出的热量为CH4的燃烧热 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 风能是正在探索的新能源之一,它是太阳能的一种转换形式,具有不稳定 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
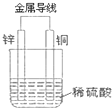 (1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑
(1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
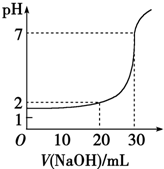 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )| A | B | C | D | |
| c(HCl)/mol•L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH)/mol•L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2中所含的阴离子数为0.2NA | |
| B. | 常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA | |
| C. | 标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA | |
| D. | Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子2个碳原子和4个氢原子不可能在同一个平面内 | |
| B. | 乙烯分子中键角约为109°28′,所有原子在同一个平面内 | |
| C. | 乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小 | |
| D. | 乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com