
| 3.84g |
| 64g/mol |
| 3.84g |
| 64g/mol |
| 0.12×2 |
| 8 |
| 3×0.12 |
| 8 |
| 0.045mol |
| 0.2L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
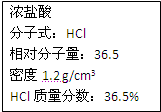 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2(g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围 ,向反应后溶液中加入4mol/L NaOH溶液 ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2011届江苏省盐城中学高三上学期期中考试化学试卷 题型:填空题
铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) ="=" Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) ="=" 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)="=" H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围 ,向反应后溶液中加入4mol/L NaOH溶液 ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三12月月考化学试卷 题型:填空题
(15分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围 ,向反应后溶液中加入4mol/L NaOH溶液 ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为 ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量 g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com