
ЎҫМвДҝЎҝ2017Дк3ФВ21ИХКЗөЪ¶юК®ОеҪмЎ°КАҪзЛ®ИХЎұЈ¬ұЈ»ӨЛ®ЧКФҙЈ¬әПАнАыУГ·ПЛ®ҪЪКЎЛ®ЧКФҙЈ¬јУЗҝ·ПЛ®өД»ШКХАыУГТСұ»ФҪАҙФҪ¶аөДИЛЛщ№ШЧўЎЈТСЦӘЈәДіОЮЙ«·ПЛ®ЦРҝЙДЬә¬УРHЈ«ЎўNH4+ЎўFe3Ј«ЎўAl3Ј«ЎўMg2Ј«ЎўNaЈ«ЎўNO3ЎӘЎўCO32ЎӘЎўSO42ЎӘЦРөДјёЦЦЈ¬ОӘ·ЦОцЖдіЙ·ЦЈ¬·ЦұрИЎ·ПЛ®СщЖ·100mLЈ¬ҪшРРБЛИэЧйКөСйЈ¬ЖдІЩЧчәНУР№ШНјПсИзПВЛщКҫЈә

Зл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ёщҫЭЙПКц3ЧйКөСйҝЙТФ·ЦОц·ПЛ®ЦРТ»¶ЁІ»ҙжФЪөДТхАлЧУКЗ_________________Ј¬Т»¶ЁҙжФЪөДСфАлЧУКЗ__________________________ЎЈ
ЈЁ2Ј©РҙіцКөСйўЫНјПсЦРіБөнҝӘКјјхЙЩЦБНкИ«ПыК§ҪЧ¶О·ўЙъ·ҙУҰөДАлЧУ·ҙУҰ·ҪіМКҪЈә__________________ЎЈ
ЈЁ3Ј©·ЦОцНјПсЈ¬ФЪФӯИЬТәЦРc(NH4+)Улc(Al3Ј«)өДұИЦөОӘ______________________Ј¬ЛщөГіБөнөДЧоҙуЦКБҝКЗ_____________________gЎЈ
ЈЁ4Ј©ИфНЁ№эКөСйИ·¶ЁФӯ·ПЛ®ЦРc(NaЈ«)=0.14 molЎӨL1,КФЕР¶ПФӯ·ПЛ®ЦРNO3КЗ·сҙжФЪЈҝ_______ЈЁМоЎ°ҙжФЪЎұЎ°І»ҙжФЪЎұ»тЎ°І»И·¶ЁЎұЈ©ЎЈ ИфҙжФЪЈ¬c(NO3)=___________molЎӨL1ЎЈЈЁИфІ»ҙжФЪ»тІ»И·¶ЁФтҙЛҝХІ»МоЈ©
Ўҫҙр°ёЎҝCO32- Na+ЎўH+ЎўAl3+ЎўNH4+ Al(OH)3 + OH©Ғ = AlO2-+2H2O 1:1 0.546 g ҙжФЪ 0.36 molЎӨL-1
ЎҫҪвОцЎҝ
ОЮЙ«ИЬТәЕЕіэМъАлЧУЈ¬СжЙ«·ҙУҰПФ»ЖЙ«Ј¬ЛөГчә¬УРДЖАлЧУЈ¬јУИлСОЛбЛб»ҜөДВИ»ҜұөИЬТәІъЙъ°ЧЙ«іБөнЈ¬ЛөГчә¬УРSO42ЎӘЈ»ЦрөОјУИлЗвСх»ҜДЖИЬТәЈ¬ҝӘКјҪЧ¶ОГ»УРіБөнЈ¬ЛөГчә¬УРЗвАлЧУЈ¬ФтТ»¶ЁІ»ҙжФЪCO32ЈӯЈ¬іБөнҙпөҪЧоҙуЦөәуЈ¬јМРшјУИлЗвСх»ҜДЖЈ¬іБөнІ»БўјҙИЬҪвЈ¬ЛөГчёГҪЧ¶О·ўЙъп§ёщУлЗвСхёщөД·ҙУҰЈ¬јҙТ»¶ЁҙжФЪNH4+Ј¬ЧоәуіБөнНкИ«ПыК§Ј¬ЛөГчіБөнЦ»УРЗвСх»ҜВБЈ¬ТтҙЛТ»¶ЁҙжФЪAl3+Ј¬Г»УРMg2Ј«Ј¬ҪбәПУР№ШКэҫЭёщҫЭөзәЙКШәг·ЦОцЕР¶ПЎЈ
ЈЁ1Ј©ОЮЙ«·ПЛ®Ј¬Т»¶ЁІ»ҙжФЪFe3+Ј¬ёщҫЭКөСйўЩИ·¶ЁҙжФЪNa+Ј¬ёщҫЭКөСйўЪИ·¶ЁҙжФЪSO42ЎӘЈ¬ёщҫЭКөСйўЫИ·¶ЁУРH+ЎўAl3+ЎўNH4+Ј¬Г»УРCO32ЈӯЎўMg2+Ј¬ТтҙЛ·ПЛ®ЦРТ»¶ЁІ»ҙжФЪөДТхАлЧУКЗCO32ЈӯЈ¬Т»¶ЁҙжФЪөДСфАлЧУКЗNa+ЎўH+ЎўAl3+ЎўNH4+Ј»
ЈЁ2Ј©КөСйўЫНјПсЦРіБөнҝӘКјјхЙЩЦБНкИ«ПыК§ҪЧ¶О·ўЙъөД·ҙУҰКЗЗвСх»ҜВБИЬҪвФЪЗвСх»ҜДЖИЬТәЦРЈ¬·ҙУҰөДАлЧУ·ҙУҰ·ҪіМКҪОӘAl(OH)3+OH©ҒЈҪAlO2-+2H2OЈ»
ёщҫЭНјПсҝЙЦӘУлп§ёщ·ҙУҰөДЗвСхёщөДОпЦКөДБҝКЗ0.042molЈӯ0.035molЈҪ0.007molЈ¬ёщҫЭ·ҙУҰNH4++OH-ЈҪNH3H2OҝЙЦӘп§ёщөДОпЦКөДБҝКЗ0.007molЈ»іБөнВБАлЧУПыәДЗвСх»ҜДЖөДОпЦКөДБҝКЗ0.035molЈӯ0.014molЈҪ0.021molЈ¬ёщҫЭ·ҪіМКҪAl3++3OHЈӯЈҪAl(OH)3ЎэҝЙЦӘВБАлЧУөДОпЦКөДБҝКЗ0.021molЎВ3ЈҪ0.007molЈ¬ЛщТФФЪФӯИЬТәЦРc(NH4+)Улc(Al3Ј«)өДұИЦөОӘ1:1Ј¬ЛщөГіБөнөДЧоҙуЦКБҝКЗ0.007molЎБ78g/molЈҪ0.546gЈ»
ЈЁ4Ј©ёщҫЭНјПсҝЙЦӘЦРәНЗвАлЧУПыәДЗвСх»ҜДЖКЗ0.014molЈ¬ФтЗвАлЧУөДОпЦКөДБҝКЗ0.014molЎЈБтЛбұөіБөнөДЦКБҝКЗ2.33gЈ¬nЈЁSO42-Ј©ЈҪ2.33gЎВ233g/molЈҪ0.01molЈ¬ёщҫЭөзәЙКШәгЈ¬ТхАлЧУөзәЙЧЬОпЦКөДБҝОӘ0.01molЎБ2ЈҪ0.02molЈ¬СфАлЧУөзәЙЧЬОпЦКөДБҝОӘnЈЁH+Ј©+nЈЁAl3+Ј©+nЈЁNH4+Ј©+nЈЁNa+Ј©ЈҪ0.014mol+0.007ЎБ3mol+0.007mol+0.14mol/LЎБ0.1LЈҪ0.056molЈ¬ФтФӯ·ПЛ®ЦРҙжФЪNO3-Ј¬ОпЦКөДБҝКЗ0.056molЈӯ0.02molЈҪ0.036molЈ¬ФтcЈЁNO3-Ј©ЈҪ0.036molЎВ0.1LЈҪ0.36mol/LЎЈ


 ҝӘРДНЬЧҙФӘІвКФҫнПөБРҙр°ё
ҝӘРДНЬЧҙФӘІвКФҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГ98%өДЕЁБтЛб(ГЬ¶ИОӘ1.84g/cm3)ЕдЦЖl00mL 1mol/LөДПЎБтЛбЈ¬ПЦзӘіцПВБРТЗЖч(ЕдЦЖ№эіМЦРҝЙДЬУГөҪ):ўЩ100mLБҝНІўЪ10mLБҝНІўЫ50mLЙХұӯ ўЬНРЕММмЖҪўЭ100mLИЭБҝЖҝўЮҪәН·өО№ЬўЯІЈБ§°фЈ¬ЕдЦЖЦРК№УГТЗЖчөДПИәунҳРтЕЕБРХэИ·өДКЗ
A. ўЬўЫўЯўЭўЮ B. ўЪўЭўЯўЮ C. ўЩўЫўЭўЮўЯ D. ўЪўЮўЫўЯўЭўЮ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРАлЧУ·ҪіМКҪХэИ·өДКЗ( )
A. ПЎH2SO4 өОФЪМъЖ¬ЙПЈә2Fe+6HЈ«![]() 2Fe3Ј«+3H2Ўь
2Fe3Ј«+3H2Ўь
B. ПЎСОЛбөОФЪМјЛбёЖЙПЈәCO32ЁD+2HЈ«![]() CO2Ўь+H2O
CO2Ўь+H2O
C. БтЛбУлЗвСх»ҜұөИЬТә»мәПЈәBa2++SO42Јӯ![]() BaSO4Ўэ
BaSO4Ўэ
D. Сх»ҜНӯУлСОЛб·ҙУҰЈәCuO +2HЈ«![]() Cu2Ј«+H2O
Cu2Ј«+H2O
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҝтНјЦРјЧЎўТТОӘөҘЦКЈ¬ЖдУаҫщОӘ»ҜәПОпЈ¬BОӘіЈјыТәМ¬»ҜәПОпЈ¬AОӘөӯ»ЖЙ«№ММеЈ¬FЎўGЛщә¬ФӘЛШПаН¬ЗТҫщОӘВИ»ҜОпЈ¬GУцKSCNИЬТәПФәмЙ«ЎЈ
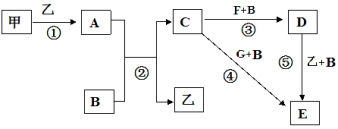
ЗлОКҙрПВБРОКМвЈә
ЈЁ1Ј©·ҙУҰўЩ-ўЭЦРЈ¬јИКфУЪСх»Ҝ»№Фӯ·ҙУҰУЦКфУЪ»ҜәП·ҙУҰөДКЗ______________ЈЁМоРтәЕЈ©ЎЈ
ЈЁ2Ј©·ҙУҰўЭөД»ҜС§·ҪіМКҪОӘ____________________________ЎЈ
ЈЁ3Ј©јЧУлB·ҙУҰөДАлЧУ·ҪіМКҪ ______________________________ЎЈ
ЈЁ4Ј©ФЪКөСйКТҪ«CИЬТәөОИлFИЬТәЦРЈ¬№ЫІмөҪөДПЦПуКЗ_____________ЎЈ
ЈЁ5Ј©ФЪFИЬТәЦРјУИлөИОпЦКөДБҝөДAЈ¬·ўЙъ·ҙУҰөДЧЬөДАлЧУ·ҪіМКҪОӘЈә___________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝXЎўYЎўZЎўMЎўWЎўQЎўRКЗ7ЦЦ¶МЦЬЖЪФӘЛШЈ¬ЖдФӯЧУ°лҫ¶ј°ЦчТӘ»ҜәПјЫИзПВЈә
ФӘЛШҙъәЕ | X | Y | Z | M | W | Q | R |
ФӯЧУ°лҫ¶/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
ЦчТӘ»ҜәПјЫ | +1 | +3 | +6Ј¬©Ғ2 | +7Ј¬©Ғ1 | +5Ј¬©Ғ3 | ©Ғ2 | +1 |
НкіЙПВБРМоҝХЈә
ЈЁ1Ј©ЙПКцФӘЛШЦРЈ¬ҪрКфРФЧоЗҝөДФЪЦЬЖЪұнЦРөДО»ЦГКЗ________________________________Ј»XЎўYЎўQёчЧФРОіЙөДјтөҘАлЧУЦРЈ¬АлЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтКЗ_______(МоАлЧУ·ыәЕ)ЎЈ
WәНR°ҙФӯЧУёцКэұИ1©s4№№іЙөДСфАлЧУЛщә¬өД»ҜС§јьКЗ____________________ЎЈ
ЈЁ2Ј©ұнЦРЛщБР4ЦЦөЪИэЦЬЖЪФӘЛШөДЧоёЯјЫСх»ҜОпөДЛ®»ҜОпјоРФЧоИхөДКЗ_______(Мо»ҜС§
КҪ)Ј¬ЖдөзАл·ҪіМКҪОӘ_____________________________________ЎЈ
ЈЁ3Ј©MУлZПаұИЈ¬·ЗҪрКфРФҪПЗҝөДКЗ_____________ЈЁМоФӘЛШГыіЖЈ©Ј¬ЗлҙУФӯЧУҪб№№өДҪЗ¶ИЛөГчАнУЙ_________________________________________________________________ЎЈ
ЈЁ4Ј©ФЪПЎБтЛбЦРЈ¬KMnO4әНH2O2ДЬ·ўЙъСх»Ҝ»№Фӯ·ҙУҰЈ¬·ҙУҰ·ҪіМКҪИзПВЈә
![]() KMnO4Ј«
KMnO4Ј«![]() H2O2+
H2O2+![]() H2SO4 Ўъ
H2SO4 Ўъ ![]() K2SO4Ј«
K2SO4Ј«![]() MnSO4Ј«
MnSO4Ј«![]() O2ЎьЈ«
O2ЎьЈ«![]() H2O
H2O
ЗлЕдЖҪЈ¬өұУР0.5 mol H2O2ІОјУҙЛ·ҙУҰЈ¬өзЧУЧӘТЖөДёцКэОӘ______________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝМјәНМјөД»ҜәПОпФЪЙъІъЎўЙъ»оЦРөДУҰУГ·ЗіЈ№г·әЎЈ ПЦҪ«І»Н¬БҝөДCO2ЈЁgЈ©әНH2ЈЁgЈ©·ЦұрНЁИлМе»эОӘ2LөДәгИЭГЬұХИЭЖчЦРЈ¬ҪшРРИзПВ·ҙУҰЈәCO2(gЈ©+H2ЈЁgЈ©![]() [Failed to download image : ]COЈЁgЈ©+H2OЈЁgЈ©Ј¬өГөҪИзПВИэЧйКэҫЭЈә
[Failed to download image : ]COЈЁgЈ©+H2OЈЁgЈ©Ј¬өГөҪИзПВИэЧйКэҫЭЈә
КөСйЧй | ОВ¶И/Ўж | ЖрКјБҝ/mol | ЖҪәвБҝ/mol | ҙпөҪЖҪәвЛщРиКұјд/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

ЈЁ1Ј©КөСй1ЦРЈ¬ЖҪәвіЈКэK=0.9Ј»vЈЁH2Ј©=0.15mol/ЈЁLminЈ©ёГ·ҙУҰөДХэ·ҙУҰОӘ______ЈЁМоЎ°ОьЎұ»тЎ°·ЕЎұЈ©ИИ·ҙУҰЈ»
ЈЁ2Ј©КөСй3ёъКөСй2ПаұИЈ¬ёДұдөДМхјюҝЙДЬКЗ___________________________
ЈЁҙрТ»ЦЦЗйҝцјҙҝЙЈ©Ј»ИфёГ·ҙУҰ·ыәПНјЛщКҫөД№ШПөЈ¬ФтФЪНјЦРYЦбұнКҫ___________________________
ЈЁ3Ј©ДЬЕР¶ПёГ·ҙУҰҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДТАҫЭКЗ______ЈЁ¶аСЎҝЫ·ЦЈ©Ј®
aЈ®ИЭЖчЦРС№ЗҝІ»ұд bЈ®»мәПЖшМеЦРcЈЁCO Ј©І»ұд
cЈ®vЈЁH2Ј©Хэ=vЈЁH2OЈ©Дж dЈ®cЈЁCO2Ј©=cЈЁCOЈ©
ЈЁ4Ј©ДіОВ¶ИПВЈ¬ЖҪәвЕЁ¶И·ыәППВКҪЈәcЈЁCO2Ј©cЈЁH2Ј©=cЈЁCOЈ©cЈЁH2OЈ©УЙҙЛҝЙТФЕР¶ПҙЛКұөДОВ¶ИОӘ______Ј®ЖдЛьМхјюІ»ұдЈ¬ЙэёЯОВ¶ИЈ¬Фӯ»ҜС§ЖҪәвПт______·ҙУҰ·ҪПтТЖ¶ҜЈЁМоЎ°ХэЎұ»тЎ°ДжЎұЈ©Ј¬ИЭЖчДЪ»мәПЖшМеөДГЬ¶И______ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©Ј®
ЈЁ5Ј©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝНЯЛ№ЦРјЧНйУлСхЖшөДЦКБҝұИОӘ1Јә4Кұј«ТЧұ¬ХЁЈ¬ҙЛКұјЧНйУлСхЖшөДМе»эұИОӘ( )
A. 1Јә4 B. 1Јә2 C. 1Јә1 D. 2Јә1
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ200mL 1molLЎӘ1өДВИ»ҜВБИЬТәЦРјУИлТ»¶ЁМе»эөД2molLЎӘ1өДNaOHИЬТәЈ¬ЧоЦХІъЙъ7.8gіБөнЈ¬ФтјУИлөДNaOHИЬТәөДМе»эҝЙДЬОӘ
ўЩ350mL ўЪ90mL ўЫ150mL ўЬ200mL
A. Ц»УРўЩ B. ўЩўЫ C. ўЪўЬ D. ўЪўЫ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЈЁ1Ј©·ҙУҰFeЈ«H2SO4ЈҪFeSO4Ј«H2ЎьөДДЬБҝұд»ҜЗчКЖЈ¬ИзНјЛщКҫЈә

ўЩёГ·ҙУҰОӘ________·ҙУҰЈЁМоЎ°ОьИИЎұ»тЎ°·ЕИИЎұЈ©ЎЈ
ўЪИфТӘК№ёГ·ҙУҰөД·ҙУҰЛЩВКјУҝмЈ¬ПВБРҙлК©ҝЙРРөДКЗ________ЈЁМоЧЦДёЈ©ЎЈ
AЈ®ёДМъЖ¬ОӘМъ·Ы BЈ®ёДПЎБтЛбОӘ98%өДЕЁБтЛб CЈ®ЙэёЯОВ¶И
ЈЁ2Ј©ГА№ъ°ўІЁВЮУоЦж·Йҙ¬ЙПК№УГБЛТ»ЦЦРВРНИјБПөзіШЈ¬Жд№№ФмИзНјЛщКҫЈ¬AЎўBБҪёцөзј«ҫщУЙ¶аҝЧөДМјҝйЧйіЙЈ¬ёГөзіШөДХэј«·ҙУҰКҪОӘЈә_______________________________ЎЈ

ЈЁ3Ј©300 ЎжКұЈ¬Ҫ«AәНBБҪЦЦЖшМе»мәПУЪәгИЭГЬұХИЭЖчЦРЈ¬·ўЙъИзПВ·ҙУҰЈә3A(g)Ј«B(g)![]() 2C(g)Ј«2D(g)Ј¬2 minД©ҙпөҪЖҪәвЎЈ
2C(g)Ј«2D(g)Ј¬2 minД©ҙпөҪЖҪәвЎЈ
ўЩ300ЎжКұЈ¬ёГ·ҙУҰөДЖҪәвіЈКэұнҙпКҪОӘKЈҪ________ЎЈ
ўЪТСЦӘK300Ўж<K350ЎжЈ¬ФтҰӨH____0(МоЎ°>Ўұ»тЎ°<Ўұ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com