
 .
.
 (标出配位键).
(标出配位键).分析 (1)Cr原子为24号元素,其满足半满和全满的稳定结构,据此书写其基态原子价层电子排布式;
(2)铍与相邻主族的铝元素性质相似.
A.Be属于s区,Al属于p区;
B.电负性都比镁大;
C.第二周期元素Mg的第一电离能比第三周期Al的大;
D.氯化物的水溶液均发生水解,溶液显酸性;
(3)①BeCl2是直线形分子,正负电荷中心重合,为非极性分子;
②b为BeCl2的二聚体(BeCl2)2,且所有原子都在平面上,Be中含有空轨道,Cl含有孤电子对,可形成配位键;
③c为BeCl2的长链状分子,一个Be与4个Cl成键,故为sp3杂化;
④氯化铍晶体与AlCl3相似,AlCl3为共价化合物,则BeCl2也为共价化合物,则为分子晶体,分子间为范德华力,含有σ键,极性键;
(4)①根据晶胞图,BeO晶体中,O2-周围等径的有4个Be2+,则配位数为4;
②根据晶体密度公式:$ρ=\frac{z{M}_{r}}{{N}_{A}V}$,其中z为一个晶胞内粒子数,一个粒子的质量,V为一个晶胞体积予以解答.
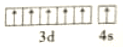
解答 解:(1)Cr原子为24号元素,其满足半满和全满的稳定结构,基态原子价层电子排布式为3d54s1,电子排布图为: .故答案为:
.故答案为: .
.
(2)铍与相邻主族的铝元素性质相似.
A.Be属于s区,Al属于p区,故A错误;
B.电负性都比镁大,故B正确;
C.第二周期元素Mg的第一电离能比第三周期Al的大,故C错误;
D.氯化物的水溶液均发生水解,溶液显酸性,则pH<7,故D正确.
故选BD.
(3))①BeCl2是直线形分子,正负电荷中心重合,为非极性分子.故答案为:非极性.
②b为BeCl2的二聚体(BeCl2)2,且所有原子都在平面上,Be中含有空轨道,Cl含有孤电子对,可形成配位键,b的结构式应为: .故答案为:
.故答案为: .
.
③c为BeCl2的长链状分子,一个Be与4个Cl成键,故为sp3杂化.故答案为:sp3.
④氯化铍晶体与AlCl3相似,AlCl3为共价化合物,则BeCl2也为共价化合物,均为分子晶体,分子间为范德华力,BeCl2中Be-Cl为σ键,且Be和Cl电负性不同,为极性键,而分子为非极性分子,所以含有的是ABC.故答案为:A、B、C.
(4))①根据晶胞图,BeO晶体中,O2-周围等径的有4个Be2+,与金刚石晶胞相似,O连接4个Be形成一个四面体,因此O的配位数为4.故答案为:4.
②立方晶胞中,顶点占$\frac{1}{8}$,面心占$\frac{1}{2}$,棱上占$\frac{1}{4}$,内部为整个晶胞所有,则一个BeO晶胞中,含有Be2+数目为$8×\frac{1}{8}+6×\frac{1}{2}=4$,O2-的数目为4,取1mol晶胞,则有NA个晶胞,1mol晶胞的质量为m=4×9+4×16=100g,一个晶胞体积为${V}_{0}={a}^{3}n{m}^{3}={a}^{3}×1{0}^{-21}c{m}^{3}$,所以1mol晶胞密度为$d=\frac{m}{{N}_{A}{V}_{0}}=\frac{100}{{N}_{A}{a}^{3}×1{0}^{-21}}g/c{m}^{3}$=$\frac{1{0}^{23}}{6.02×1{0}^{23}{a}^{3}}g/c{m}^{3}=\frac{1}{6.02{a}^{3}}g/c{m}^{3}$,所以$a=\root{3}{\frac{1}{6.02d}}$.故答案为:$\root{3}{\frac{1}{6.02d}}$.
点评 本题考查物质结构知识,包含电子排布式,电子排布图,元素周期表,电负性,第一电离能,盐类水解,晶体结构,杂化轨道理论,晶胞计算.题目考查较综合,难度中等,是中档题.


科目:高中化学 来源: 题型:解答题
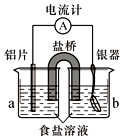 银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.将变黑的银质器皿放入图装置,一段时间后发现黑色会褪去.回答下列问题:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.将变黑的银质器皿放入图装置,一段时间后发现黑色会褪去.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:PO>Te | B. | 为非金属元素 | ||
| C. | ${\;}_{84}^{209}$PO的中子数为125 | D. | 在周期表中第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HBr→CH3CH2Br | ||
| C. | 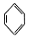 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$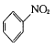 +H2O +H2O | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和水 | B. | 溴苯和苯 | C. | 食盐水和泥沙 | D. | 硝酸钾和硫酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com