
【题目】氧化铁红(Fe2O3)用途广泛,用废铁皮制取铁红的部分流程示意图如下:
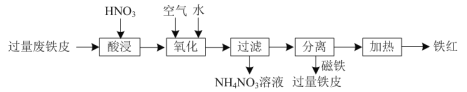
⑴“酸浸”时发生反应的离子方程式是______。
⑵“氧化”时有红褐色沉淀生成,该反应的离子方程式为______。
⑶将铁红与FeS2混合焙烧可以生成磁性氧化铁和SO2,该反应的化学方程式为______。
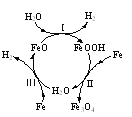
⑷“淬火”是将红热的铁器浸入水中急速冷却以增加铁器的硬度以及减缓腐蚀,反应历程如图,写出该历程中第Ⅰ步反应的方程式______。
【答案】4Fe+NO3-+10H+=4Fe2++NH4++3H2O 4Fe2++O2+10H2O=4Fe(OH)3↓+8H+ 16Fe2O3+FeS2=11Fe3O4+2SO2↑ 2FeO + 2H2O=2FeOOH+ H2↑
【解析】
“酸浸”时,废铁皮中铁被硝酸氧化为Fe2+,在“氧化”阶段,Fe2+被空气氧化为Fe3+,因有红褐色沉淀生成,则可推出生成了Fe(OH)3,经过滤得到的滤渣中含Fe(OH)3和过量的铁,滤液中含NH4NO3,再利用磁铁分离出过量的铁,将得到的Fe(OH)3加热制备得到铁红,据此分析作答。
(1)根据工艺流程可知,“酸浸”时过量的铁被硝酸氧化生成硝酸亚铁、硝酸铵和水,发生反应的离子方程式为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(2)红褐色沉淀为氢氧化铁,则“氧化”过程发生的反应为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+;
(3)根据氧化还原反应的规律可知,铁红与FeS2混合焙烧可以生成磁性氧化铁和SO2,+2价的Fe元素化合价升高到+![]() 价,-1价的S元素化合价升高到+4价,而+3价的Fe元素化合价降低到+
价,-1价的S元素化合价升高到+4价,而+3价的Fe元素化合价降低到+![]() ,根据电子转移数守恒和原子守恒可配平该氧化还原反应为:16Fe2O3+FeS2=11Fe3O4+2SO2↑;
,根据电子转移数守恒和原子守恒可配平该氧化还原反应为:16Fe2O3+FeS2=11Fe3O4+2SO2↑;
(4)第Ⅰ步反应是FeO和H2O反应生成FeOOH和H2的过程,根据氧化还原反应的规律配平可得2FeO + 2H2O=2FeOOH+ H2↑。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
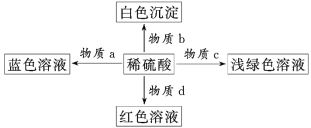
选项 | 物质a | 物质b | 物质c | 物质d |
A | Cu2(OH)2CO3 | Ba(OH)2 | Fe(OH)3 | 酚酞溶液 |
B | CuO | NaAlO2 | Fe2O3 | 紫色石蕊溶液 |
C | CuO | BaCl2 | FeO | 酚酞溶液 |
D | Cu(OH)2 | Ba(NO3)2 | FeO | 紫色石蕊溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列方案对A 盐的水溶液进行鉴定:

由此得出的结论中一定不正确的是( )
A.D溶液中存在Fe(SCN)3B.A 一定为无氧酸盐FeBr2
C.B可为AgBrD.滤液中有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
⑴写出过氧化氢的电子式________。
⑵反应的热化学方程式为_________。
⑶此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个优点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是( )
A. 离子晶体NH4Cl的所有原子的最外层均满足2个或8个电子的稳定结构,离子晶体NH4H的所有原子的最外层电子均满足2个或8个电子的稳定结构
B. 固态CO2是分子晶体,固态SiO2也是分子晶体
C. NCl3中N原子是sp3杂化,BCl3中B原子也是sp3杂化
D. 已知Be与Al的化学性质相似,Al(OH)3、Be(OH)2都能与NaOH溶液反应,且生成的盐都可用NaXO2表示(X表示Al或Be)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2可用于化学镀镍,常通过反应“P4+3NaOH+3H2O==3NaH2PO2+PH3↑”制得,产物PH3中P的化合价为-3。下列说法正确的是
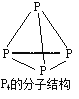
A.P4分子中含有的共价键是极性键
B.31g P4中所含P-P键的物质的量为6 mol
C.反应中还原剂和氧化剂的物质的量之比为1∶3
D.反应生成2.24 L PH3(标准状况),转移电子数目为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】很多非金属元素是地球上组成生命的基本元素,特别是碳元素、氧元素与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。请回答下列问题:
(1)基态碳原子最外层有______种空间运动状态不同的电子,其价电子排布图(即价电子轨道表示式)为______。
(2)写出COS的电子式:_______,中心原子的杂化轨道类型为_______杂化,写出与COS互为等电子体的粒子化学式(分子与离子各一种):________、_______。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
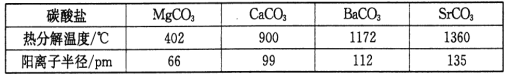
试从生成物角度分析为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?___________。
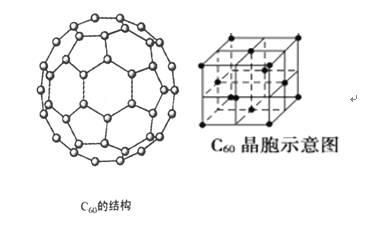
(4)碳的一种同素异形体—C60,又名足球烯,是一种高度对称的球碳分子(C60分子结构和C60晶体的晶胞结构如下图所示)。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体中组成的C8H8与C60分子个数比为__________。
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体中组成的C8H8与C60分子个数比为__________。
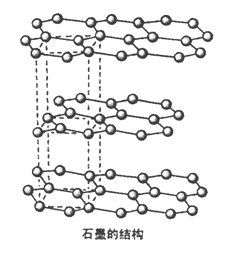
(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Y、Z三种元素可组成酸,且受热易分解
D.由X、Z、W三种元素可组成碱,且受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
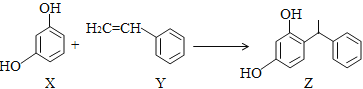
下列叙述正确的是( )。
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能与Na2CO3溶液反应放出CO2
C. X、Y和Z分子中的所有原子可能共平面
D. X苯环上一氯代物有3种,Y苯环上的二氯代物有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com