
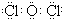 ��
��
���� ��1����2����3��������A�����ֶ�����Ԫ����ɣ�����A��NH3��Ӧ�������Ӿ���C�����嵥��D�ͳ���Һ��E��DΪ�����к����������ʣ���DΪN2������Һ��EΪH2O������Ԫ���غ��֪��AΪ�ȵ���������A����Կ���������ܶ�Ϊ3.0��������Է�������Ϊ3��29=87����A������Clԭ����ĿΪż����ֻ��Ϊ2��������ԭ����Ŀ=$\frac{87-35.5��2}{16}$=1����AΪCl2O������֪���ӻ�����CΪNH4Cl��A����ˮ�ɵ�ֻ����һ����B����������Һ��B��Һ�ڷ��ù����������Ի���ǿ��BΪHClO������A����ijһ���嵥���볱ʪ��Na2CO3��Ӧ�Ƶã�ͬʱ�����������Σ���Ԫ���غ��֪���õ�������ΪCl2�����ɵ���������ֻ��ΪNaHCO3��NaCl���ݴ˽��1����2����3����
��4����ԭ����У�þ��������������þʧ���ӷ���������Ӧ��������ӦΪMg-2e-=Mg2+����ط�ӦʽΪMg+ClO-+H2O=Mg��OH��2��+Cl-�������ϴ���������ӵõ��ӷ�����ԭ��Ӧ���ݴ���д��ط�Ӧ���ɵ����غ��֪��Mg��2e-��Fe2+����ԭ���غ��֪Fe2+��Fe��OH��3�����Դ˼��㣮
��� �⣺ij���Ȼ�����A�����ֶ�����Ԫ����ɣ�����A��NH3��Ӧ�������Ӿ���C�����嵥��D�ͳ���Һ��E��DΪ�����к����������ʣ���DΪN2������Һ��EΪH2O������Ԫ���غ��֪��AΪ�ȵ���������A����Կ���������ܶ�Ϊ3.0��������Է�������Ϊ3��29=87����A������Clԭ����ĿΪż����ֻ��Ϊ2��������ԭ����Ŀ=$\frac{87-35.5��2}{16}$=1����AΪCl2O������֪���ӻ�����CΪNH4Cl��A����ˮ�ɵ�ֻ����һ����B����������Һ��B��Һ�ڷ��ù����������Ի���ǿ��BΪHClO������A����ijһ���嵥���볱ʪ��Na2CO3��Ӧ�Ƶã�ͬʱ�����������Σ���Ԫ���غ��֪���õ�������ΪCl2�����ɵ���������ֻ��ΪNaHCO3��NaCl��
��1��������������֪������A�Ļ�ѧʽΪCl2O��AΪ���ۻ�����ĵ���ʽΪ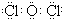
�ʴ�Ϊ��Cl2O��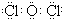 ��
��
��2������A��NH3��Ӧ�Ļ�ѧ����ʽΪ��3Cl2O+10NH3=6NH4Cl+2N2+3H2O����Ӧ��Cl�Ļ��ϼ۽��ͣ��÷�Ӧ��������Cl2O���������ԣ�
�ʴ�Ϊ��3Cl2O+10NH3=6NH4Cl+2N2+3H2O��
��3��Cl2�볱ʪ��̼���Ʒ�Ӧ����Cl2O��ͬʱ���ɵ���������ֻ��ΪNaHCO3��NaCl����ѧ����ʽΪ��2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl��������ǡ����ȫ��Ӧ�����ɵ���������NaHCO3��NaCl�Ļ��������ˮ�γ���Һ��ʾ���ԣ�̼��������ӵ�ˮ��̶ȴ��ڵ���̶ȣ�
A�����������غ㣬�õ�c��Na+����2c��HCO3-��+2c��H2CO3��+2c��CO32-������A����
B�����ݵ���غ㣺c��OH-��+c��Cl-��=c��HCO3-��+2c��CO32-��+c��H+������B����
C����������������NaHCO3��NaCl�Ļ�����У�̼��������ӵ�ˮ��̶ȴ��ڵ���̶ȣ�����c��Na+����c��Cl-����c��HCO3-����c��CO32-����c��H2CO3��
����C��ȷ���ʴ�Ϊ��2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl��C��
��4����ԭ����У�þ��������������þʧ���ӷ���������Ӧ��������ӦΪMg-2e-=Mg2+�������ϴ���������ӵõ��ӷ�����ԭ��ӦMg+ClO-+H2O=Cl-+Mg��OH��2����ط�ӦʽΪ���缫��Ӧ֮�ͣ���Mg+ClO-+H2O=Mg��OH��2��+Cl-�����е�þ�缫��ԭ��صĸ�����Ӧ�ú͵�Դ�ĸ���������
�ɵ����غ��֪��3Mg��6e-��3Fe2+��Cr2O72-��2Cr3+��2Cr��OH��3������n��Mg��=$\frac{3.6g}{24g/mol}$=0.15mol�����Ľ���þ0.15mol��ת�Ƶ�����0.3mol����ʱ�õ��ĸ�������0.1mol������������0.1mol��103g/mol=10.3g���ʴ�Ϊ��10.3g��
���� ���⿼�������ƶϡ�ԭ��صĹ���ԭ����������ԭ��Ӧ�е����غ�ļ���ȣ����ؿ���ѧ����֪ʶ���ۺ�Ӧ�ü���������������Ҫѧ���߱���ʵ�Ļ������ѶȽϴ�


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Ϊͬϵ����һ�ȴ���ֻ�����ֵ����ʵĽṹ��ʽ��
��Ϊͬϵ����һ�ȴ���ֻ�����ֵ����ʵĽṹ��ʽ�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���еļױ�����ˮ�� | B�� | 95.6%�Ҵ��е�ˮ��CaO�� | ||
| C�� | �����е���ϩ�����Ը�����أ� | D�� | �屽�е��壨���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
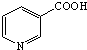 ���׳����ᣬ����ˮ������Ѫ��������ҩ����������գ�
���׳����ᣬ����ˮ������Ѫ��������ҩ����������գ� ���Լ�Ũ���ᡢŨ���ᣮ
���Լ�Ũ���ᡢŨ���ᣮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ͱ�ˮ��Ӧ H++OH-=H2O | |
| B�� | �ƺ���ˮ��Ӧ Na+2H2O=Na++2OH-+H2�� | |
| C�� | ����������������Һ��Ӧ Cl2+2OH-=Cl-+ClO-+H2O | |
| D�� | ͭ��ϡ���ᷴӦ Cu+2NO3-+4H+=2Cu2++2NO2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�CH3COONa��CaCl2�����Һ��c��Na+��+c��Ca2+��=c��CH3COO-��+c��CH3COOH��+2c��Cl-�� | |
| B�� | ��ͬ�¶��£�0.6 mol•L-1��ˮ��0.3 mol•L-1��ˮ��c��OH-��֮����2��1 | |
| C�� | ��0.1 mol•L-1NaNO3��Һ�еμ�����ʹ��Һ��pH=5����ʱ���Һ�е�c��Na+��=c��NO3-�� | |
| D�� | �����£�0.1 mol•L-1NH4Cl��Һ��0.1 mol•L-1��ˮ�������ϣ�pH��7������c��NH3•H2O����c��NH4+����c��Cl-����c��OH-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com