
【选修2化学与技术】(20分)
20-I(6分)下列有关叙述正确的是
A.碱性锌锰电池中,MnO2是催化剂 B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大 D.电镀时,待镀的金属制品表面发生还原反应
20-Ⅱ(14分)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
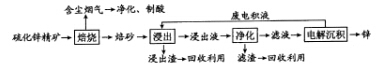
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
20-I BD 20-Ⅱ (1)ZnO (2)浸出 (3)锌粉 置换出Fe等 (4)O2
(5) 2ZnS+4H++ O2=2Zn2++2S↓+2H2O. (6) ZnCO3+2C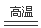 Zn+3CO↑
Zn+3CO↑
【解析】
试题分析:20-I A.碱性锌锰电池中,MnO2是正极,错误。B,银锌纽扣电池工作时,Ag2O中的+1价的Ag得到电子被还原为单质Ag。Zn单质失去电子,被氧化,作负极。正确。C.放电时,铅酸蓄电池中硫酸由于不断被消耗,所以浓度不断减小,错误。D.电镀时,待镀的金属制品作阴极,在阴极上发生还原反应,所以表面有一层镀层金属附着在镀件表面。正确。20-Ⅱ (1) 由于硫化锌精矿的成分是ZnS,焙烧在氧气气氛的沸腾炉中进行,发生反应:2ZnS+3O2 2ZnO+2SO2。因此所产生焙砂的主要成分是ZnO。(2)焙烧过程中产生的含尘烟气主要成分是SO2可净化制酸,该酸可用于后续的浸出操作。(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是置换出Fe等;(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,由于电极是惰性电极,所以在阳极是溶液中的OH-放电,电极反应是:4OH--4e-=2H2O+ O2↑.所以阳极逸出的气体是氧气。(5)根据题意可得 “氧压酸浸”中发生的主要反应的离子方程式为2ZnS+4H++ O2=2Zn2++2S↓+2H2O. (6) 用焦炭煅烧炉甘石的化学反应方程式为ZnCO3+2C
2ZnO+2SO2。因此所产生焙砂的主要成分是ZnO。(2)焙烧过程中产生的含尘烟气主要成分是SO2可净化制酸,该酸可用于后续的浸出操作。(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是置换出Fe等;(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,由于电极是惰性电极,所以在阳极是溶液中的OH-放电,电极反应是:4OH--4e-=2H2O+ O2↑.所以阳极逸出的气体是氧气。(5)根据题意可得 “氧压酸浸”中发生的主要反应的离子方程式为2ZnS+4H++ O2=2Zn2++2S↓+2H2O. (6) 用焦炭煅烧炉甘石的化学反应方程式为ZnCO3+2C Zn+3CO↑。
Zn+3CO↑。
考点:考查原电池、电解池的反应原理、试剂的作用、金属的冶炼方法及反应条件的控制的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014北京市海淀区高三第二学期二模理综化学试卷(解析版) 题型:选择题
下列有关NH3的实验正确的是
A | B | C | D |
| |
|
|
实验室制NH3 | 证明NH3极易溶于水 | 收集NH3 | 吸收多余NH3 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:填空题
(13分)
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
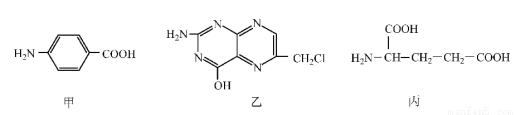
(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法正确的是 (填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为 。
a.含有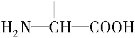 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
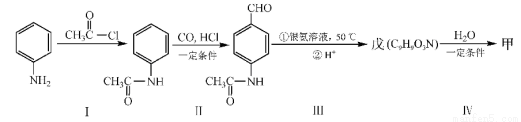
①步骤I的反应类型是 。
②步骤I和Ⅳ在合成甲过程中的目的是 。
③步骤Ⅳ反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:选择题
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 -
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32 -)
D.温度升高,c(HCO3- )增大
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:填空题
(8分)卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多卤代甲烷作为溶剂,其中分子结构为正四面体的是__________。工业上分离这些多卤代甲烷的方法是_______________________。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式__________(不考虑立体异构)。
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下: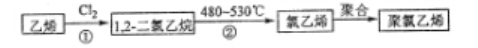
反应①的化学方程式是_____________,反应类型为_______,反应②的反应类型为___________。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
某反应过程能量变化如图所示,下列说法正确的是
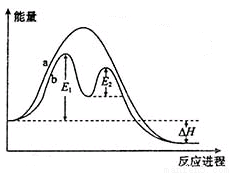
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,可改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(浙江卷解析版) 题型:选择题
下列说法正确的是
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可检测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:填空题
(15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐? 其溶液显 性(填弱酸性、中性、或者弱碱性)
(3)(H3PO2)的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2),后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)(H3PO2)也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
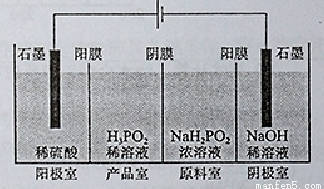
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是 杂质。该杂质产生的原因是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com