
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示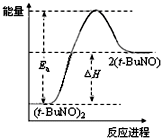 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
| (0.5×75%×2)2 |
| 0.5×(1-75%) |
| (0.5×75%×2)2 |
| 0.5×(1-75%) |
| 0.5×75%×2mol/L |
| 10min |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中无硝酸亚铁 |
| B、反应前HNO3溶液的浓度为2.0mol?L-1 |
| C、反应后溶液中c(NO3-)=1.6mol?L-1 |
| D、反应后的溶液最多还能溶解1.61g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入溴水中 | 验证SO2具有漂白性 |
| B | 在滴有酚酞的Na2CO3溶液中, 加入BaCl2溶液后红色褪去 |
验证Na2CO3溶液中存在水解平衡 |
| C | 淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸腾 | 检验淀粉水解产物有还原性 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 |
| B、向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| C、将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 |
| D、将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
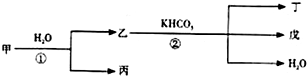 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com