
已知Co2O3在酸性溶液中易被还原成Co2+,其Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 4FeI3 + 2FeCl3
B.Cl2 + FeI2 = FeCl3 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O
D.2Fe3+ + 2I— = 2Fe2+ + I2
科目:高中化学 来源:2015届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列过程中,共价键被破坏的是
A.HCl气体溶于水 B.酒精溶于水
C.冰融化成水 D.碘升华
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列关于氧化还原反应说法正确的是
A.肯定有一种元素被氧化,另一种元素被还原
B.某元素从化合态变成游离态,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:填空题
(8分)水在很多的反应中,起到极其重要的作用。根据下面水参与的反应,回答问题:
① 2F2+2H2O==4HF+O2
②2Na2O2+2H2O== 4NaOH + O2↑
③2Na+2H2O==2NaOH+H2↑
④2H2O 2H2↑+O2↑
2H2↑+O2↑
(1)水只作氧化剂的是 ;(填写序号,下同)水只作还原剂的是 ;水既作氧化剂,又做还原剂的是 ;水既不是氧化剂,又不是还原剂的氧化还原反应是 。
(2)请标出下列反应的电子转移的方向和数目。3Cl2 +6 NaOH=5NaCl + NaClO3 + 3H2O
(3)上述反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O若转移5mol电子,则所得氧化产物的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2︰4︰1︰1,则M离子可能是下列中的
A.Cl- B.OH- C.Mg2+ D.Na+
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列溶液中,Na+ 物质的量浓度最大的是
A.100mL 0.1mol·L-1的Na2SO4溶液
B.100mL 0.01 mol·L-1的NaCl溶液
C.10mL 0.1mol·L-1的NaOH溶液
D.1mL 0.5mol·L-1的NaNO3溶液
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:选择题
小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是
A.溶解度(s) B.物质的量浓度(c)
C.质量分数(w) D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:填空题
(10分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
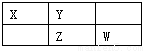
(1)元素Z位于周期表中第_______周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________
(4)Y的最高价氧化物的水化物与其氢化物反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高三上期第一次月考理综化学试卷(解析版) 题型:实验题
(14分)某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取7.5mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100 mL 1.0 mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏小(填写字母)____。
A 用量筒量取浓盐酸时,俯视量筒的刻度 B容量瓶未干燥即用来配制溶液
C浓盐酸在烧杯中稀释时,搅拌时间过长 D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线 F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤②_______________ 步骤③___________
(3)实验步骤⑤中应选用__________(填字母)的量筒。
A.100 mL B.200 mL C.500 mL
(4)读数时除恢复到室温外,还要注意①______________,②_____________________。
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____L/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com