
【题目】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________,σ键和π键数目之比为_____________。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________,中心离子的配位数为________________。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________。
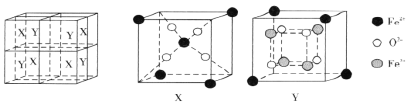
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________。已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则该品体的晶胞参数a=_______pm(用含d和NA的代数式表示)。
【答案】![]() 3 平面三角形 X射线衍射 sp3杂化 5:4 [Co(NH3)5Cl]Cl2 6 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 Fe3O4
3 平面三角形 X射线衍射 sp3杂化 5:4 [Co(NH3)5Cl]Cl2 6 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 Fe3O4 ![]() ×1010
×1010
【解析】
(1)硒为34号元素,有6个价电子,据此书写价层电子排布图;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;气态SeO3分子Se原子孤电子对数=![]() =0,价层电子对数=3+0=3,为平面三角形;
=0,价层电子对数=3+0=3,为平面三角形;
(2)确定晶体、非晶体的方法是X射线衍射
(3)根据(SCN)2分子中分子结构式为N≡C-S-S-C≡N分析;
(4)配合物中配位离子Cl-不与Ag+反应,据此计算出外界离子Cl-离子的数目,据此分析解答;
(5)根据产物FeO的晶格能和CoO的晶格能比较进行分析;
(6)根据均摊法确定微粒个数,即可确定化学式;晶胞参数a=![]() ×1010cm。
×1010cm。
(1)硒为34号元素,有6个价电子,价电子排布图为![]() ;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,因此同一周期p区元素第一电离能大于硒的元素有3种,分别为As、Br、Kr; 气态SeO3分子Se原子孤电子对数=
;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,因此同一周期p区元素第一电离能大于硒的元素有3种,分别为As、Br、Kr; 气态SeO3分子Se原子孤电子对数=![]() =0,价层电子对数=3+0=3,为平面三角形;
=0,价层电子对数=3+0=3,为平面三角形;
答案:![]() 3 平面三角形
3 平面三角形
(2)确定某种金属互化物是晶体还是非晶体的方法是是X射线衍射
答案:X射线衍射
(3)(SCN)2分子中分子结构式为N≡C-S-S-C≡N,每个S原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论知硫原子的杂化方式为sp3,该分子中σ键和π键数目之比为5:4;
答案:sp3杂化 5:4
(4)配合物的物质的量为0.2mol/L×100×10-3L=0.02mol,氯化银的物质的量为![]() ,配合物中配位离子Cl-不与Ag+反应,1mol该配合物生成2mol AgCl沉淀,所以1mol该配合物中含2mol外界离子Cl-,即配离子中含有2个Cl-,该配合物的化学式可写为:[Co(NH3)5Cl]Cl2,中心离子配位数6;
,配合物中配位离子Cl-不与Ag+反应,1mol该配合物生成2mol AgCl沉淀,所以1mol该配合物中含2mol外界离子Cl-,即配离子中含有2个Cl-,该配合物的化学式可写为:[Co(NH3)5Cl]Cl2,中心离子配位数6;
答案:[Co(NH3)5Cl]Cl2 6
(5)因为Fe2+的半径小于Co2+,所以FeO的晶格能大于CoO,生成物FeO比CoO稳定,所以FeCO3的分解温度低于CoCO3;
答案:Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解
(6)根据图示可知晶胞中含4个X、4个Y,每个X中含Fe3+:4×1/8+1=3/2,O2-:4;每个Y中含Fe3+:4×1/8=1/2,Fe2+:4 O:4 则晶胞中共有Fe3+:4×(3/2+1/2)=8 ,Fe2+:4×4=16 O2-:(4+4)×4=32,晶胞中铁与氧个数比为(8+16):32=3:4,氧化物的化学式为Fe3O4;晶胞参数a=![]() =
=![]() ×1010pm=
×1010pm=![]() ×1010pm
×1010pm
答案:![]() ×1010
×1010


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
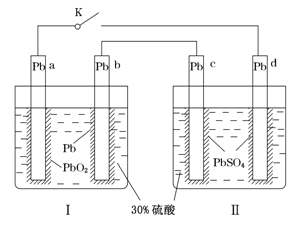
A. 闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. 闭合K时,Ⅱ中SO42—向c电极迁移
D. 闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(气) + 3B(气) ![]() 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.气体的总体积是反应开始时的 3/5
C.混合气体的密度不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学用语中,不正确的是
A. FeCl3溶液刻蚀铜电路板:2Fe3++Cu==2Fe2++Cu2+
B. Na2O2用作供氧剂:Na2O2+H2O==2NaOH +O2↑
C. 氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32![]() CaCO3(s)+SO42
CaCO3(s)+SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用平衡移动原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com