
| A. |  溶解食盐 | B. |  蒸发结晶 | C. |  进行定容 | D. |  收集NO2 |
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将试剂瓶中的Na2CO3溶液倒入试管,发现取量过多,将过量的试剂倒回试剂瓶中 | |
| B. | 将含有Ba(NO3)2的废液倒入指定的容器中回收 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,立刻转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝 | |
| D. | 生铁、普通钢和不锈钢中的含碳量依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
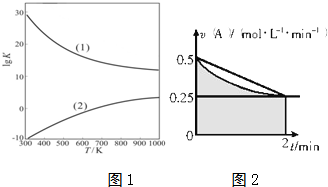
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
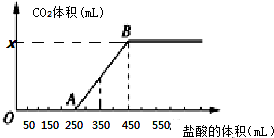
| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- | |
| B. | 当加入350 mL盐酸时,产生CO2的体积为224 mL(标准状况) | |
| C. | x点对应的数值是448 | |
| D. | 混合物中NaOH的质量为1克 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

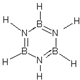 ,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.
,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
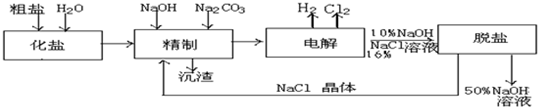
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
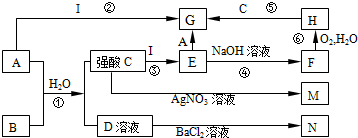
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com