
| A、离子化合物中可能含有共价键 |
| B、共价化合物中可能还有离子键 |
| C、两种元素组成的分子中一定只有极性键 |
| D、非金属元素组成的化合物一定是共价化合物 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、R的单质与稀盐酸反应速率L<R |
| B、L与T形成的化合物具有两性 |
| C、Q、T两元素的氢化物热稳定性Q<T |
| D、L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧杯、坩埚、试管、锥形瓶都可以用酒精灯直接加热 |
| B、银镜反应、乙醛与新制Cu(0H)2反应、实验室制取乙烯都必须用水浴加热 |
| C、制取氨气、氢气时都可以用向下排空气法收集 |
| D、石油的分馏、实验室制取乙炔和制取蒸馏水都要用到冷凝装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断正确的是( )
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断正确的是( )| A、图中线段oa:ab=3:1 |
| B、NaOH溶液物质的量浓度为0.6 mol?L-1 |
| C、在b点处溶液中的溶质只有Na[Al(OH)4] |
| D、混合溶液中Al3+与Mg2+物质的量比值为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、涉及的离子方程式为:Cu+2Fe3+═2Fe2++Cu2+ |
| B、溶液中c(Fe3+):c(Cu2+)=4:3 |
| C、Cu片溶解了1.95g |
| D、此反应可应用于印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n(Ca) |
| n(P) |
| n(Ca) |
| n(P) |

| n(Ca) |
| n(P) |
| PH值 | 6.8 | 7.2 | 8.0 | 9.0 | 10.0 | ||
| 产率(%) | 92.6 | 95.3 | 96.7 | 94.6 | 95.6 | ||
|
1.51 | 1.50 | 1.51 | 1.52 | 1.52 |
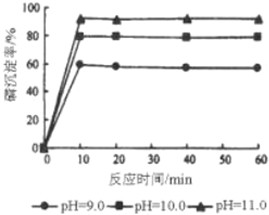
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com