
【题目】为制取硝酸铜,某同学设计了如下四种方法:①铜与浓硝酸反应制取硝酸铜;②铜与稀硝酸反应制取硝酸铜;③铜先与空气反应制取氧化铜,再与硝酸反应制取硝酸铜;④铜与硝酸银溶液反应制取硝酸铜。
(1)方法②中被氧化的铜与被还原的硝酸的物质的量之比是 。
(2)“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,杜绝污染源,提高原子利用率是绿色化学的重要衡量指标。请从“绿色化学”和经济效益角度考虑,大量制取硝酸铜宜采用上述第 (填序号)种方法,原因是 。
【答案】(1)3∶2
(2)③;只有方法③中硝酸的利用率高,成本低且无污染气体产生,而方法①、②中原子利用率不高且会产生污染,方法④中的成本偏高,经济效益差
【解析】(1)方法②中铜与稀硝酸反应的化学方程式为3Cu+8HNO3![]() 3Cu(NO3)2+2NO↑+4H2O,在反应中消耗的8分子硝酸中,只有2分子的化合价降低,即只有2分子被还原,所以铜与被还原的硝酸的物质的量之比为3∶2。(2)方法①中铜与浓硝酸反应的化学方程式为Cu+4HNO3(浓)
3Cu(NO3)2+2NO↑+4H2O,在反应中消耗的8分子硝酸中,只有2分子的化合价降低,即只有2分子被还原,所以铜与被还原的硝酸的物质的量之比为3∶2。(2)方法①中铜与浓硝酸反应的化学方程式为Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,铜与浓、稀硝酸反应时不是所有的N都转化成硝酸铜,另外在反应时会产生NO、NO2两种污染气体;方法④中用硝酸银作反应物时的成本太高;方法③中是铜与氧气反应生成氧化铜,再用氧化铜与硝酸反应,则硝酸中的N全部进入了硝酸铜中,所以原子利用率最高,且在生产过程中不产生污染。综上所述,方法③最合理。
Cu(NO3)2+2NO2↑+2H2O,铜与浓、稀硝酸反应时不是所有的N都转化成硝酸铜,另外在反应时会产生NO、NO2两种污染气体;方法④中用硝酸银作反应物时的成本太高;方法③中是铜与氧气反应生成氧化铜,再用氧化铜与硝酸反应,则硝酸中的N全部进入了硝酸铜中,所以原子利用率最高,且在生产过程中不产生污染。综上所述,方法③最合理。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述正确的是( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池放电时,电流的方向是从正极到负极
C. 比较不活泼的金属为负极
D. 在原电池中,电子流出的一极是负极,该电极被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。
试回答下列问题:

(1)电源A极的名称是 。
(2)甲装置中电解反应的总化学方程式: 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的主要成分是 (填化学式)。
(5)装置丁中的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
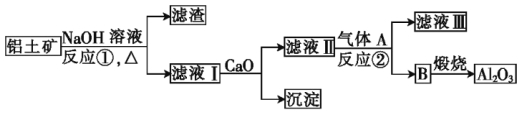
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
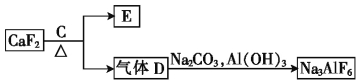
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
请回答下列问题:
(1)写出反应①的化学方程式: 。
(2)滤液Ⅰ中加入CaO生成的沉淀是 (填化学式),反应②的离子方程式为 。
(3)写出由气体D制备冰晶石的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案不能达到实验目的的是
A. 用碘水鉴别淀粉溶液和食盐水
B. 用澄清石灰水鉴别Na2CO3和NaHCO3溶液
C. 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
D. 除去Cl2中HCl,将混合气体依次通过饱和食盐水和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国的火力发电机组绝大多数为燃煤机组,而以燃煤为主的电力生产所造成的环境污染是制约电力工业发展的一个重要因素,其中氮氧化物(NOx)是继粉尘和二氧化硫之后燃煤电站环保治理的重点。
(1)燃煤烟气脱硫的方法很多,如石灰石—石膏法、氨水法等。其中石灰石-石膏法脱硫的原理第一步是SO2+Ca(OH)2![]() CaSO3+H2O,然后再将产物氧化制成石膏,写出该反应的化学方程式: 。
CaSO3+H2O,然后再将产物氧化制成石膏,写出该反应的化学方程式: 。
(2)燃煤烟气脱硝可采用氨(NH3)作为还原介质,在催化剂及氧气存在的条件下,氮氧化物(NOx)与还原剂发生反应,生成无害的氮气和水,写出二氧化氮与氨反应的化学方程式: 。
(3)我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:
浓度限值(mg·m-3) | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0.70 |
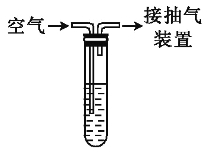
现有某化学兴趣小组按图所示的实验装置对某地空气中二氧化硫含量进行测定:向试管中加入1.00 mL 1.00×10-3 mol·L-1碘水,加入适量水,再加入2~3滴淀粉溶液使溶液显蓝色,通过抽气装置缓慢抽气,使空气由导气管进入试管与碘水充分反应,当溶液由蓝色变为无色时,恰好完全反应(反应的化学方程式:SO2+I2+2H2O![]() H2SO4+2HI),实验过程中进入试管内的空气的总体积为0.1 m3。请计算此空气中二氧化硫的浓度为多少mg·m-3,并判断二氧化硫的浓度级别为几级。
H2SO4+2HI),实验过程中进入试管内的空气的总体积为0.1 m3。请计算此空气中二氧化硫的浓度为多少mg·m-3,并判断二氧化硫的浓度级别为几级。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2 、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)![]() 2SO2(g)+O2(g);△H =+196.6 kJ/mol
2SO2(g)+O2(g);△H =+196.6 kJ/mol
B.2SO2(g)+O2(g)![]() SO3(g);△H =-98.3 kJ/mol
SO3(g);△H =-98.3 kJ/mol
C.SO2(g)+1/2O2(g)![]() SO3(g);△H=+98.3 kJ/mol
SO3(g);△H=+98.3 kJ/mol
D.SO2(g)+1/2O2(g)![]() SO3(g);△H=-196.6 kJ/mol
SO3(g);△H=-196.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是
A. 不溶于水,且必须易与碘发生化学反应
B. 不溶于水,且比水更容易使碘溶解
C. 不溶于水,且必须比水密度大
D. 不溶于水,且必须比水密度小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com