
| A. | 1.0摩尔 | B. | 1.6摩尔 | C. | 2.2摩尔 | D. | 2.0摩尔 |
分析 铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
解答 解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,
则n(NO2)+n(NO)=$\frac{22.4L}{22.4L/mol}$=1.0mol,
即被还原的硝酸的物质的量为1.0mol,
n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,则生成n(Cu(NO3)2)=0.6mol,
可知表现酸性的硝酸的物质的量为0.6mol×2=1.2mol,
则:参加反应的硝酸的物质的量为:1.0mol+1.2mol=2.2mol,
故选C.
点评 本题考查化学方程式的计算,题目难度中等,侧重于学生的分析、计算能力的考查,但该题可不书写写有关反应的方程式,注意浓硝酸和稀硝酸的性质的不同,从质量守恒的角度解答该题.


科目:高中化学 来源: 题型:解答题
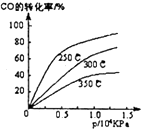 工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
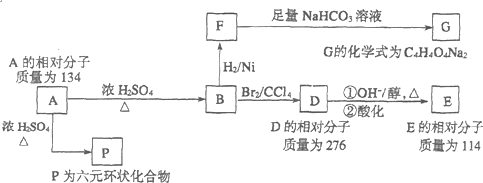
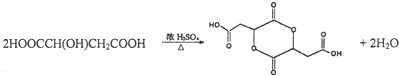 .
.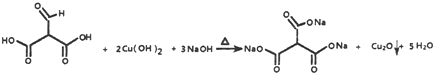 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

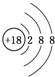 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.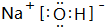
 HClO+HCl.
HClO+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
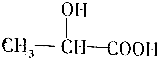 ,
,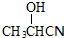 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com