
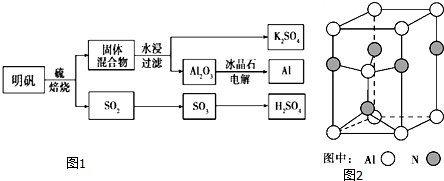
分析 明矾和硫焙烧得到固体混合物和SO2,二氧化硫氧化为三氧化硫,溶于水生成硫酸,固体混合物水浸过滤得到硫酸钾溶液和固体氧化铝,加入冰晶石电解熔融氧化铝得到金属铝,
(1)化学方程式中元素化合价变化分析,元素化合价升高的做还原剂发生氧化反应;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化,可以利用蒸发溶剂方法结晶析出;
(3)配位化合物中直接和中心原子(或离子)相联系的配位原子的数目;
(4)以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,NiO(OH)得到电子发生还原反应,结合原子守恒和电子守恒写出反应化学方程式;
(5)①依据热化学方程式和盖斯定律计算Ⅲ-Ⅰ-2×Ⅱ得到所需热化学方程式;
②硫元素守恒计算得到硫酸质量.
解答 解:(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,复印纸还原剂是硫单质;
故答案为:S;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化不大,可以利用蒸发溶剂方法结晶析出晶体,
故答案为:蒸发结晶;
(3)依据晶体晶胞结构分析,结合配位数含义可知,每个铝原子和四个单原子相连,所以铝原子的配位数为4,
故答案为:4;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,铝做负极失电子在氢氧化钠溶液中生成偏铝酸钠,反应的化学方程式为:
Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 ,
故答案为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;
(5)①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;Ⅰ
H2O(g)?H2O(l)△H2=-44kJ/mol;Ⅱ
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.Ⅲ
依据盖斯定律Ⅲ-Ⅰ-2×Ⅱ得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-260kJ/mol,
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
②948 t明矾生成SO2物质的量为4500mol 故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t,
故答案为:432.
点评 本题考查了氧化还原反应概念分析判断,晶体结构的理解分析,原电池反应的实质应用,热化学方程式和盖斯定律的计算,元素守恒的计算应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率可以用反应物的转化率大小来描述 | |
| B. | 影响化学反应速率的条件并不只是温度、浓度、压强和催化剂 | |
| C. | 化学平衡状态指的是反应物和生成物浓度相等时的状态 | |
| D. | 催化剂既能加快化学反应速率,又能提高原料利用率或转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1mol•L-1+c(OH-) | |
| C. | 向X点所表示的溶液中加入等体积的0.05mol•L-1 NaOH溶液:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 该温度下醋酸的电离平衡常数为10-1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| B. | Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2 c(H2CO3) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(NH4+)>c(Na+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | Y<X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com