
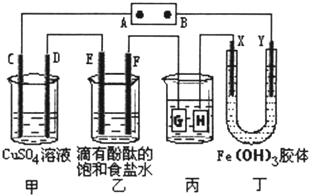
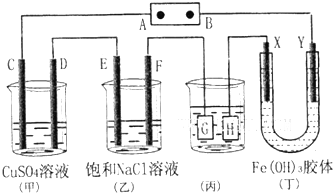
 ČēĶ¼ĖłŹ¾£¬C”¢D”¢E”¢F”¢X”¢Y¶¼ŹĒ¶čŠŌµē¼«£¬¼×”¢ŅŅÖŠČÜŅŗµÄĢå»żŗĶÅØ¶Č¶¼ĻąĶ¬£Ø¼ŁÉčĶصēĒ°ŗóČÜŅŗĢå»ż²»±ä£©£¬A”¢BĪŖĶā½ÓÖ±Į÷µēŌ“µÄĮ½¼«£®½«Ö±Į÷µēŌ“½ÓĶØŗ󣬶”ÖŠX¼«ø½½üµÄŃÕÉ«Öš½„±äĒ³£¬Y¼«ø½½üµÄŃÕÉ«Öš½„±äÉī£®Ēė»Ų“š£ŗ
ČēĶ¼ĖłŹ¾£¬C”¢D”¢E”¢F”¢X”¢Y¶¼ŹĒ¶čŠŌµē¼«£¬¼×”¢ŅŅÖŠČÜŅŗµÄĢå»żŗĶÅØ¶Č¶¼ĻąĶ¬£Ø¼ŁÉčĶصēĒ°ŗóČÜŅŗĢå»ż²»±ä£©£¬A”¢BĪŖĶā½ÓÖ±Į÷µēŌ“µÄĮ½¼«£®½«Ö±Į÷µēŌ“½ÓĶØŗ󣬶”ÖŠX¼«ø½½üµÄŃÕÉ«Öš½„±äĒ³£¬Y¼«ø½½üµÄŃÕÉ«Öš½„±äÉī£®Ēė»Ų“š£ŗ·ÖĪö £Ø1£©C”¢D”¢E”¢Fµē¼«×ŖŅʵĵē×ÓŹżÄæĻąµČ£¬½įŗĻµē¼«·“Ó¦Ź½øł¾Ż×ŖŅʵē×ÓŹżæɼĘĖćÉś³ÉµÄµ„ÖŹµÄĮ棻
£Ø2£©µē¶Ę×°ÖĆÖŠ£¬¶Ę²ć½šŹō±ŲŠė×öŃō¼«£¬¶Ę¼ž×öŅõ¼«£¬µē¶ĘŅŗŗ¬ÓŠ¶Ę²ć½šŹōŃōĄė×Ó£»øł¾ŻŅŅÖŠĒāŃõøłĄė×ÓµÄÅØ¶Č¼ĘĖćĘäĪļÖŹµÄĮ棬½į¹¹µē¼«·“Ó¦Ź½¼ĘĖć×ŖŅʵē×ÓĪļÖŹµÄĮ棬ø÷øöµē¼«ÉĻ×ŖŅʵĵē×ÓŹżŹĒĻąµČµÄ£¬¾Ż“Ė¼ĘĖć±ūÖŠĪö³öAgµÄĪļÖŹµÄĮ棬½ų¶ų¼ĘĖćÖŹĮ棻
£Ø3£©Fe£ØOH£©3“ęŌŚČēĻĀĘ½ŗā£ŗFe£ØOH£©3£Øs£©?Fe3+£Øaq£©+3OH-£Øaq£©£¬øł¾ŻFe£ØOH£©3µÄČܶȻż³£ŹżŗĶĒāŃõøłĄė×ÓÅØ¶Č¼ĘĖćĢśĄė×ÓÅØ¶Č¼ĘĖć£»
£Ø4£©n£ØKOH£©=2mol/L”Į2L=4mol£¬øĆ×°ÖĆŹĒČ¼ĮĻµē³Ų£¬øŗ¼«ÉĻ¼×Ķ鏧µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«ÉĻŃõĘųµĆµē×Ó·¢Éś»¹Ō·“Ó¦£¬øł¾ŻŌ×ÓŹŲŗćµĆ2mol£¼n£ØCO2£©”Ü4mol£¬·“Ӧɜ³ÉĢ¼ĖįĒā¼Ų£®
½ā“š ½ā£ŗ£Ø1£©C”¢D”¢E”¢Fµē¼«·¢ÉśµÄµē¼«·“Ó¦·Ö±šĪŖ£ŗ4OH-ØTO2”ü+2H2O+4e-”¢Cu2++2e-ØTCu”¢2Cl-ØTCl2”ü+2e-”¢2H++2e-ØTH2”ü£¬µ±ø÷µē¼«×ŖŅʵē×Ó¾łĪŖ1molŹ±£¬Éś³Éµ„ÖŹµÄĮæ·Ö±šĪŖ£ŗ0.25mol”¢0.5mol”¢0.5mol”¢0.5mol£¬ĖłŅŌµ„ÖŹµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ2£ŗ2£ŗ2£»
¹Ź“š°øĪŖ£ŗ1£ŗ2£ŗ2£ŗ2£»
£Ø2£©µē¶Ę×°ÖĆÖŠ£¬¶Ę²ć½šŹō±ŲŠė×öŃō¼«£¬¶Ę¼ž×öŅõ¼«£¬ĖłŅŌHÓ¦øĆŹĒ¶Ę¼ž£¬µē¶ĘŅŗŗ¬ÓŠ¶Ę²ć½šŹōŃōĄė×Ó£¬¹Źµē¶ĘŅŗĪŖAgNO3ČÜŅŗ£»µ±ŅŅÖŠČÜŅŗµÄpHŹĒ13Ź±£¬ČÜŅŗµÄc£ØOH-£©=0.1mol•L-1Ź±£¬øł¾Żµē¼«·“Ó¦2H2O+2e-ØTH2”ü+2OH-£¬Ōņ·ÅµēµÄĒāĄė×ÓµÄĪļÖŹµÄĮæĪŖ£ŗ0.1mol/l”Į0.5L=0.05mol£¬µ±×ŖŅĘ0.05molµē×ÓŹ±£¬±ūÖŠ¶Ę¼žÉĻĪö³öŅųµÄÖŹĮæ=108g/mol”Į0.05mol=5.4g£¬¹Ź“š°øĪŖ£ŗ5.4g£»
£Ø3£©Fe£ØOH£©3±„ŗĶČÜŅŗÖŠ£¬c£ØH+£©=10-5mol/L£¬Fe£ØOH£©3?Fe3++3OH-Éś³ÉµÄĒāŃõøł£ŗc£ØOH-£©=10-9mol/L£¬øł¾ŻKsp=c£ØFe3+£©•c£ØOH-£©3=1”Į10-36£®½āµĆc£ØFe3+£©=10-9mol/L£¬¹Ź“š°øĪŖ£ŗ10-9£»
£Ø4£©n£ØKOH£©=2mol/L”Į2L=4mol£¬øĆ×°ÖĆŹĒČ¼ĮĻµē³Ų£¬øŗ¼«ÉĻ¼×Ķ鏧µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«ÉĻŃõĘųµĆµē×Ó·¢Éś»¹Ō·“Ó¦£¬44.8L£¼V”Ü89.6LŹ±£¬øł¾ŻŌ×ÓŹŲŗćµĆ2mol£¼n£ØCO2£©”Ü4mol£¬·“Ӧɜ³ÉĢ¼ĖįĒā¼Ų£¬øŗ¼«·“Ó¦Ź½ĪŖCH4-8e-+9CO32-+3H2O=10HCO3-£¬
¹Ź“š°øĪŖ£ŗCH4-8e-+9CO32-+3H2O=10HCO3-£®
µćĘĄ ±¾Ģāæ¼²éѧɜӊ¹Ųµē½ā³ŲµÄ¹¤×÷ŌĄķÖŖŹ¶£¬×ŪŗĻŠŌŗÜĒ棬ÄŃ¶Č½Ļ“ó£¬ŅŖĒóѧɜŹģ¼Ē½Ģ²ÄÖŖŹ¶£¬Ń§ŅŌÖĀÓĆ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ĄÖ¹µē³ŲÖŠ¹Æ”¢ļÓ”¢øõ”¢Ē¦µČÖŲ½šŹōŌŖĖŲ¶ŌĶĮČĄŗĶĖ®Ō“µÄĪŪČ¾ | |
| B£® | »ŲŹÕĘäÖŠµÄŹÆÄ«µē¼« | |
| C£® | ²»Ź¹µē³ŲÉųŠ¹µÄµē½āŅŗøÆŹ“ĘäĖūĪļĘ· | |
| D£® | »ŲŹÕĘäÖŠµÄø÷ÖÖ½šŹō¼°ĖÜĮĻ°ü×°µČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ”÷H=-2 878 kJ•mol-1 | B£® | ”÷H=-2 658 kJ•mol-1 | ||
| C£® | ”÷H=-1 746 kJ•mol-1 | D£® | ”÷H=-1 526 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
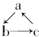 £Ø”°”ś”±±ķŹ¾Ņ»²½Ķź³É£©¹ŲĻµĻą»„×Ŗ»ÆµÄÓŠ£Ø””””£©
£Ø”°”ś”±±ķŹ¾Ņ»²½Ķź³É£©¹ŲĻµĻą»„×Ŗ»ÆµÄÓŠ£Ø””””£©| ĪļÖŹ ±ąŗÅ | a | b | c |
| 1 | Al2O3 | NaAlO2 | Al£ØOH£©3 |
| 2 | FeO | Fe£ØNO3£©2 | Fe£ØOH£©2 |
| 3 | MgCl2 | Mg£ØOH£©2 | MgO |
| 4 | CuO | CuSO4 | Cu£ØOH£©2 |
| 5 | Si | SiO2 | H2SiO3 |
| 6 | C | CO | CO2 |
| A£® | 1Ļī | B£® | 2Ļī | C£® | 3Ļī | D£® | 4Ļī |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2 mol SO2£Øg£©ŗĶ1mol O2£Øg£©¾ßÓŠµÄÄÜĮæÖ®ŗĶµĶÓŚ2 mol SO3£Øg£©¾ßÓŠµÄÄÜĮæ | |
| B£® | ½«2 mol SO2£Øg£©ŗĶ1mol O2£Øg£©ÖĆÓŚŅ»ĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦ŗó·Å³öQ kJµÄČČĮæ | |
| C£® | ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ÉĻŹöČČ»Æѧ·½³ĢŹ½ÖŠµÄQÖµ¼õŠ” | |
| D£® | ½«Ņ»¶ØĮæSO2£Øg£©ŗĶO2£Øg£©ÖĆÓŚÄ³ĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦ŗó·ÅČČQ kJ£¬Ōņ“Ė¹ż³ĢÖŠÓŠ2 mol SO2±»Ńõ»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ¢Ł | B£® | ¢Ś | C£® | ¢Ū | D£® | ¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻąĶ¬Ģõ¼žĻĀ£¬N2ŗĶO3µÄ»ģŗĻĘųĢåÓėµČĢå»żµÄN2Ėłŗ¬Ō×ÓŹżĻąµČ | |
| B£® | ±ź×¼×“æöĻĀ£¬28 g COŗĶ22.4 L H2OĖłŗ¬·Ö×ÓŹżĻąµČ | |
| C£® | 5.6 gĢś·ŪÓė×ćĮæŃĪĖį³ä·Ö·“Ó¦£¬ÓŠ0.2 molµē×Ó×ŖŅĘ | |
| D£® | µČÖŹĮæµÄCH4ŗĶNH3Ėłŗ¬µē×ÓŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com