
| A.热稳定性:SiH4<PH3<H2O | B.酸性:H3PO4>H2SO4>HClO4 |
| C.碱性:NaOH > Mg(OH)2> Al(OH)3 | D.金属性:Na > Mg > Al |
科目:高中化学 来源:不详 题型:单选题
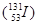 、铯-137
、铯-137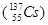 说法正确的是
说法正确的是| A.碘-131的中子数为78 | B.碘-131质量数为53 |
| C.碘与铯互称同位素 | D.铯-137的放射性是化学性质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35Cl原子所含质子数为18 |
| B.1/18mol的1H35Cl分子所含中子数约为6.02×1023 |
| C.35g35Cl2气体的体积约为11.2L |
| D.35Cl2气体的摩尔质量为71g.mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH、KOH、CsOH碱性依次增强 |
| B.Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 |
| C.Al、Mg、Na的原子半径依次减小 |
| D.HCl、H2S、PH3稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在化合物 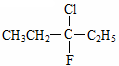 中,存在手性碳原子 中,存在手性碳原子 |
| B.原子间形成分子时,决定各原子相互结合的数量关系的是共价键的饱和性? |
| C.根据对角线规则判断Be(OH)2是两性氢氧化物 |
| D.在相同条件下,邻羟基苯甲醛的沸点高于对羟基苯甲醛 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 性异构
性异构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com