
 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
分析 向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,发生的反应为Cl2+H2O?HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,根据溶液的酸碱性结合电荷守恒和物料守恒分析解答.
解答 解:A.①点时没有加入氢氧化钠,溶液中存在HClO和水的电离平衡,故A错误;
B.②点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故B正确;
C.②点时溶液存在Cl0-,具有强氧化性,可氧化I-,故C错误;
D.①到②溶液c(H+)之间减小,酸对水的电离的抑制程度减小,则水的电离程度逐渐增大,故D错误.
故选B.
点评 本题综合考查氯气的性质,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,题目难度中等.


科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列有关气体摩尔体积的说法中正确的是
A.在标准状况下,1 mol任何物质的体积都约为22.4 L
B.在标准状况下 ,0.5 mol任何气体的体积都约为11.2 L
,0.5 mol任何气体的体积都约为11.2 L
C.在常温常压下,1 mol任何气体的体积都约为22.4 L
D.在标准状况下,0.5 mol CCl4所占有的体积约为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
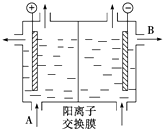 按要求完成下列各小题
按要求完成下列各小题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为2.8g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | |
| ⑥摇匀、装瓶、贴上标签 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: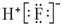 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: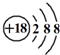 | |
| D. | 溴化钠的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com