
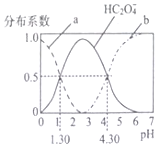
 H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )| A. | 曲线a代表H2C2O4,曲线b代表C2O42- | |
| B. | 常温下0.1mol/L的NaHC2O4溶液显酸性 | |
| C. | 常温下,H2C2O4的电离平衡常数Ka2=10-4..30 | |
| D. | pH从1.30~4.30时,$\frac{c({H}_{2}{C}_{2}{O}_{4})}{c({C}_{2}{O}_{4}^{2-})}$先增大后减小 |
分析 A.随着溶液的pH增大,溶液中H2C2O4逐渐减少,HC2O4-逐渐增多,pH大于3时,HC2O4-逐渐减少,C2O42-逐渐增多;
B.当溶液中HC2O4-和C2O42-相同时,溶液显酸性,所以HC2O4-的电离程度大于C2O42-的水解程度;
C.常温下,H2C2O4的电离平衡常数Ka2=$\frac{c({C}_{2}{{O}_{4}}^{2-})×c({H}^{+})}{c(H{C}_{2}{{O}_{4}}^{-})}$,结合图象计算;
D.pH从1.30~4.30时,H2C2O4的浓度逐渐减小,C2O42-逐渐增多.
解答 解:A.随着溶液的pH增大,溶液中H2C2O4逐渐减少,HC2O4-逐渐增多,pH大于3时,HC2O4-逐渐减少,C2O42-逐渐增多,所以曲线a代表H2C2O4,曲线b代表C2O42-,故A正确;
B.当溶液中HC2O4-和C2O42-相同时,溶液显酸性,所以HC2O4-的电离程度大于C2O42-的水解程度,即常温下0.1mol/L的NaHC2O4溶液中以HC2O4-的电离为主,溶液显酸性,故B正确;
C.常温下,H2C2O4的电离平衡常数Ka2=$\frac{c({C}_{2}{{O}_{4}}^{2-})×c({H}^{+})}{c(H{C}_{2}{{O}_{4}}^{-})}$,由图象可知,pH=4.30时,c(HC2O4-)=c(C2O42-),则Ka2=10-4..30,故C正确;
D.pH从1.30~4.30时,H2C2O4的浓度逐渐减小,C2O42-逐渐增多,所以$\frac{c({H}_{2}{C}_{2}{O}_{4})}{c({C}_{2}{O}_{4}^{2-})}$逐渐减小,故D错误.
故选D.
点评 本题考查酸碱混合物的定性判断和计算,侧重于学生的分析能力和计算能力的考查,注意把握图象的含义,C选项为易错点,注意对平衡常数的理解与灵活运,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
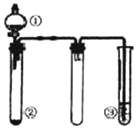 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
| D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
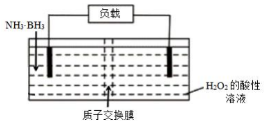 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | BO2-通过质子交换膜向正极移动 | |
| C. | 负极附近溶液pH增大 | |
| D. | 正极的反应式为 3H2O2+6H++6e-═6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
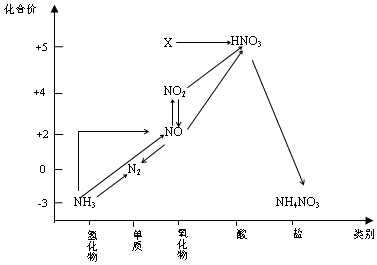
| A. | X是N2O5 | |
| B. | 可用排空气法收集NO气体 | |
| C. | 工业上以NH3、空气、水为原料生产硝酸 | |
| D. | 由NH3→N2,从原理上看,NH3可与NO2反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 | 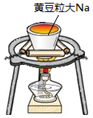 | 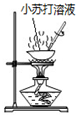 | 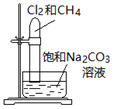 | 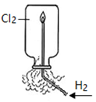 |
| 目的 | Na在空气中燃烧 | 提取NaHCO3晶体 | CH4与Cl2取代反应 | H2在Cl2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、ClO‐、SO42‐、HCO3‐一定能共存于 c(Fe3+)=0.1mol•L‐l 的溶液中 | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 在NaClO和NaCl混合溶液中滴入过量SO2气体,反应的离子方程式为:SO2+3C1O‐+H2O═SO42‐+C1‐+2HClO | |
| D. | Na+、HCO3-、Br-、Mg2+可以在 pH=8 的溶液中共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A元素最简单的氢化物的电子式为
A元素最简单的氢化物的电子式为 .
. ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;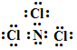 ;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.
;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com