
(12分)I.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙和一种氮肥。请根据要求答问题:
(1)写出该反应的化学方程式 。
(2)如何判断所得碳酸钙是否为纳米级 。
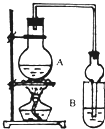
Ⅱ.某实验小组设计下图装置测定SO2转化成SO3的转化率。已知SO3的熔点16.8℃,沸点是44.8℃。已知发生装置中反应的化学方程式为:
Na2SO3(s)+H2SO4
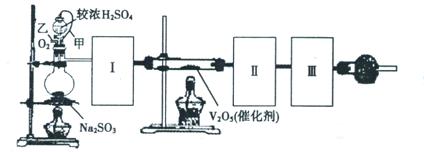
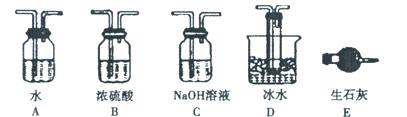
(1)根据实验需要,请从下图A~E装置中选择最适合装置,连接在I、Ⅱ、Ⅲ处。
Ⅰ Ⅱ Ⅲ 。
(2)在检查完装置气密性后,从乙处均匀通入O2,在实验中先加热催化剂后滴加浓硫酸,这样操作后在装置I和装置Ⅱ之间发生的反应的化学方程式 。
(3)发生装置的分液漏斗上接橡皮管甲的目的是 。
(4)用126g Na2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间,若测得装置Ⅲ增重了51.2g,则实验中SO2的转化率为 。
(本题12分)
I.(1)CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl(2分)
(2)用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是(2分)
II.(1)B、D、C(全对计2分,只要一个错计0分)
(2)2SO2+
O2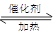 2SO3(略反应条件和可逆号)(2分,反应条件和可逆号各占1分)
2SO3(略反应条件和可逆号)(2分,反应条件和可逆号各占1分)
(3)使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下(2分)
(4))20%(2分)
【解析】I.(1)根据原子守恒可知,另一种氮肥应该是氯化铵,所以该反应的化学方程式是CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl。
(2)由于纳米材料的微粒直径介于1nm和100纳米之间,所以纳米材料形成的分散系应该是胶体,而检验是否为胶体的方法是丁达尔效应。即用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是。
II.(1)根据题意可知,实验原理是利用生成的SO2被氧化生成三氧化硫,然后然后分别通过测量剩余的SO2和生成的三氧化硫即可测定SO2转化成SO3的转化率。由于生成的SO2中含有水蒸气,因此首先要干燥SO2,选择浓硫酸。由于三氧化硫的熔点低,剩余通过冰水来来收集生成的三氧化硫,最后剩余的SO2用氢氧化钠溶液吸收,剩余正确的答案选B、D、C。
(2)在催化剂的作用下,SO2被氧化生成三氧化硫,反应的化学方程式是2SO2+ O2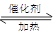 2SO3。
2SO3。
(3)由于在反应中生成气体SO2,所以必须保持内外压强相等,以使浓硫酸顺利滴下,所以作用是使分液漏斗和烧瓶内气压平衡,保证较浓硫酸能够顺利流下。
(4)126g Na2SO3固体可以生成1molSO2,质量是64g,而剩余的SO2气体是51.2g,所以实验中SO2的转化率为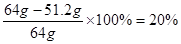 。
。


科目:高中化学 来源: 题型:阅读理解
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
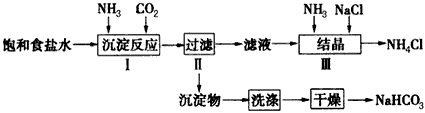

试简述将浓氨水滴入锥形瓶中的操作:_________________。
(2)若用图2装置进行该沉淀反应,反应方程式为:NaCl +NH3+CO2+H2O=NaHCO3↓+NH4Cl。实验时,须先从______(填“a”、“b”或“c”)口通入__________。
(3)步骤Ⅲ向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①已知四种相关物质不同温度下的溶解度曲线如图3所示,则结晶时宜采用________(填“蒸发结晶” 或“降温结晶”)。
②某同学设计了如图4所示的装置来验证所得的晶体中含有NH4+。
具体操作:取少量晶体于硬质试管中,对晶体部位加热。并在____(填“A”或“B”)处放置____ 试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等。
①准确称量ag样品溶于水,加入足量沉淀剂。沉淀剂最好选用____。
A.Ca(OH)2溶液 B.CaCl2溶液 C.BaCl2溶液 D.Ba(OH)2溶液
②过滤、洗涤、烘干,冷却、称量,称得固体质量为bg。
③重复以上“烘干,冷却、称量”操作,直至____ 为止。此时称得固体质量为cg。
④计算:样品中NaHCO3的含量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I下列实验设计、操作或实验现象合理的是_________(填序号)
A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
 II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有过量乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液。试回答:
(1)A中浓硫酸的作用是
反应中加入的乙醇是过量的,其目的是________________________________。
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式 ;
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是_______________________ 。
(4)反应结束后D中的现象是 。
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com