
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
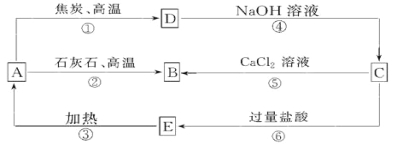
请回答:
(1)写出对应物质的化学式:A__________; C__________; E__________。
(2)反应①的化学方程式为: 。
(3)反应④的离子方程式为: 。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明: _________________________。
【答案】(1)(3分)SiO2 Na2SiO3 H2SiO3(或H4SiO4)
(2)(2分)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(3)(2分)Si+2OH-+H2O=== SiO32-+2H2↑
(4)(2分)SiO32-+CO2+H2O===H2SiO3↓+HCO32-
或SiO32-+CO2+H2O===H2SiO3↓+CO32- (写成H4SiO4同样给分)
【解析】
试题分析:非金属单质R能与NaOH溶液反应生成盐(Na2RO3)和氢气,则R为Si元素,由转化关系可知D为Si,A为SiO2,B为CaSiO3,C为Na2SiO3,E为H2SiO3,
(1)由以上分析可知A为SiO2,C为Na2SiO3,故答案为:SiO2;Na2SiO3;
(2)反应①的化学方程式为2C+SiO2![]() Si+2CO↑;
Si+2CO↑;
(3)反应④的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑;
(4)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。


科目:高中化学 来源: 题型:
【题目】分类是学习化学的方法之一,下列各组物质按氧化物、酸、碱、盐顺序排列的一组是( )
A.氢氧化铁、硝酸、烧碱、氯化钠
B.干冰、碳酸、纯碱、硫酸钾
C.水、硫酸、熟石灰、氯化钾
D.氨水、醋酸、氢氧化铁、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I-![]() 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。

说明:0.005 mol·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500 ℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g) ![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
ΔH=-9 072 kJ·mol-1 K=1.1×1026
②4NH3(g)+4O2(g) ![]() 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
ΔH=-1104.9 kJ·mol-1 K=4.4×1028
③4NH3(g)+3O2(g) ![]() 2N2 (g)+6H2O(g)
2N2 (g)+6H2O(g)
ΔH=-1 269.02 kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
A.增大O2浓度
B.使用合适的催化剂
C.减小压强
D.降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中物质的量最多的是(NA表示阿伏伽德罗常数)
A. 1 mol CO2
B. 标准状况下44.8 L H2
C. 3NA个水分子
D. 1 L 1 mol/L的碳酸钠溶液中含的溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl﹣物质的量之比( )
A.6:5
B.3:2
C.15:2
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一体积为10 L的容器中,通入一定量的CO和H2O,在850 ℃时发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g);ΔH<0。CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=____ mol/(L·min)。
CO2(g)+H2(g);ΔH<0。CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=____ mol/(L·min)。
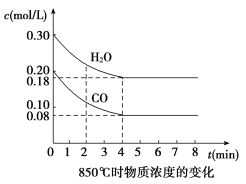
t1 ℃时物质浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(2)t1 ℃(高于850 ℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。请回答:
①表中3~4 min之间反应处于________状态;c1数值________0.08 mol/L(填大于、小于或等于)。
②反应在4~5 min间,平衡向逆方向移动,可能的原因是________(单选),表中5~6 min之间数值发生变化,可能的原因是________(单选)。
a.增加了水蒸气的量 b.降低温度
c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= ;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为 。
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com