
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

(1)装置甲中盛放浓硝酸的仪器A的名称是______,该装置中发生反应的化学方程式为________________________。
(2) 装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
【答案】 分液漏斗 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3NO2+H2O===2H++2NO![]() +NO 氧气 黄 红(或“血红”) CH4(g)+2NO2(g)===N2(g)+2H2O(g)+CO2(g) ΔH=-957.3 kJ·mol-1
+NO 氧气 黄 红(或“血红”) CH4(g)+2NO2(g)===N2(g)+2H2O(g)+CO2(g) ΔH=-957.3 kJ·mol-1
【解析】(1)装置甲中盛放浓硝酸的仪器A的名称是分液漏斗;烧瓶中发生浓硝酸与铜片的氧化还原反应,化学方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,;
(2)二氧化氮经导管进入丙装置和水反应的离子方程式为3NO2+H2O═2H++2NO3-+NO;
(3)因在常温下一氧化氮易被氧气氧化成红肿色的二氧化氮,所以为了探究NO的还原性,可以在装置丁的导气管C中通入氧气;
(4)丙装置中的液体为二氧化氮和水反应生成的硝酸,硝酸具有氧化性,硫酸亚铁具有还原性,两者发生氧化还原反应4H++NO3-+3Fe2+=NO+H2O+3Fe3+;铁离子和硫氰根离子反应Fe3++3SCNFe(SCN)3生成血红色的络合物,可证明三价铁离子的生成;
(5)CH4还原NO2生成水蒸气和氮气发生反应为:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g),根据盖斯定律可知,①-②可得热化学方程式:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)△H=-957.3kJmol-1。


科目:高中化学 来源: 题型:
【题目】①已知t ℃时AgCl的Ksp=2×10-10;②Ag2CrO4是一种橙红色的固体。在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A. 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,可以采用K2CrO4溶液为指示剂
B. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
C. 在t ℃时,以0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液, CrO42-先沉淀
D. 在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+ CrO42- (aq)的平衡常数K=2.5×105
2AgCl(s)+ CrO42- (aq)的平衡常数K=2.5×105
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关蒸馏的装置和操作的说法中,不正确的是( )
A.温度计的水银球不应插入蒸馏烧瓶内的液体中,而应放在烧瓶的支管口
B.冷凝管内水流方向与蒸气流方向要一致
C.实验时在烧瓶中应加几块碎瓷片以防溶液剧烈沸腾
D.蒸馏烧瓶加热时底部必须垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原子晶体中只存在非极性共价键B. 稀有气体形成的晶体属于分子晶体
C. 干冰升华时,分子内共价键会发生断裂D. 金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素的叙述,正确的是
A. 碳元素在生物体中的含量一定是最多的
B. 动物和植物所含化学元素的种类和含量相同
C. 组成生物体的化学元素在自然界中很难找到
D. C、H、O、N是构成细胞的主要元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
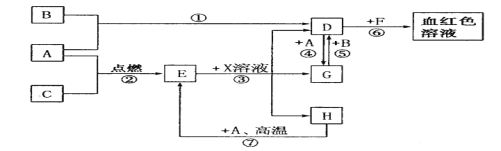
请回答下列问题:
(1)写出下列物质的化学式:A______、X______。
(2)在反应;① ~⑦中,属于氧化还原反应的有____个;反应⑥说明D溶液中含有___离子。
(3)反应④的离子方程式是__________。
(4)反应⑦的化学方程式是__________。
(5)检验D的溶液中是否含有G离子的方法是_________。
(6)除去D溶液中混有的少量G的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下列操作步骤进行提纯:

①先加入氧化剂X,再加入物质Y,过滤得沉淀Z。
②将滤液蒸发结晶得纯CuCl2·2H2O晶体。
已知:三种离子在溶液中完全变成氢氧化物沉淀所需pH值如下表。
离子 | Fe3+ | Cu2+ | Fe2+ |
pH | 3.7 | 6.4 | 6.4 |
试回答下列问题:
(1)加入氧化剂X的目的是______________________________________。
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是_________。
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
此过程发生反应的离子方程式为_____________________________________。
(3)物质Y可以用______________(填一种物质),沉淀Z是____________。
(4)为分离出沉淀Z采取的实验操作是_________________。
(5)步骤②所用的仪器有铁架台(含铁圈)、酒精灯、玻璃棒和_________,如要获得无水CuCl2,应采取的操作是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钡与盐酸反应2H++BaCO3===Ba2++H2O+CO2↑
B. 氢氧化钡溶液与稀硫酸混合Ba2++![]() +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
C. 金属钠与水的反应 Na+H2O===Na++OH-+H2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com