
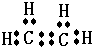 .
.分析 (1)乙烯是含有碳碳双键的最简单的烯烃,据此书写电子式;
(2)乙烯中含有碳碳双键,可以发生加成反应,可以被强氧化剂氧化,而甲烷不能;
(3)乙烯与溴发生加成反应,据此书写化学反应方程式.
解答 解:(1)乙烯中含碳和碳之间以共价双键结合,电子式为 ,故答案为:
,故答案为: ;
;
(2)乙烯中含有碳碳双键,可以发生加成反应,使溴水褪色,可以被强氧化剂高锰酸钾氧化,从而使高锰酸钾褪色,而甲烷不能,所以D正确,故答案为:D;
(3)乙烯与溴发生加成反应,化学反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应.
点评 本题考查了乙烯的结构与性质,题目难度不大,注意掌握乙烯的分子组成、结构及具有的化学性质,明确常见物质的鉴别与检验方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol/(L•s) | B. | vB=0.2mol/(L•s) | C. | vC=0.9mol/(L•s) | D. | vD=1.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:Fe3++3OH-=Fe(OH)3↓ | |
| B. | 稀硝酸中加入过量的铁粉:3Fe+2NO${\;}_{3}^{-}$+8H+=3Fe2++2NO↑+4H2O | |
| C. | 向Na2SiO3溶液中加入通入过量的H2S:SiO32-+H2SiO3↓+S2- | |
| D. | 向含amolFel2的水溶液中通入amol的Cl2反应为:2Fe2-+2l-+2Cl2=2Fe2++4Cl-+l2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
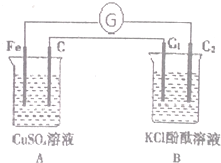 按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)
按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题: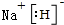 ;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.
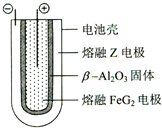
;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑. Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com