
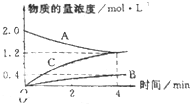
 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:| △c |
| △t |
| 800℃ |
| 800℃ |
| 0.8mol/L |
| 4min |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| 固体催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为提高粮食产量,应大量使用化肥和农药 |
| B、人体缺钙会引起骨质疏松症,因此钙元素摄入得越多越好 |
| C、自行车支架上刷上油漆既美观又能防止钢铁生锈 |
| D、人可以食用含黄曲霉素的变质食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入到乙醇中 |
| B、红热的木炭投入到热的浓硝酸中 |
| C、电石投入到水中CaC2 |
| D、加热溴乙烷与NaOH乙醇溶液的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(SO2)=0.3 mol/(L?s) |
| B、v(SO2)=0.15 mol/(L?s) |
| C、v(SO2)=0.6 mol/(L?s) |
| D、v(SO2)=0.5 mol/(L?s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com