
| A. | FeCl3易溶于水,可用作净水剂 | |
| B. | 硅是半导体材料,纯净的硅是光纤制品的基本原料 | |
| C. | 浓硫酸能干燥氯气,说明浓硫酸具有吸水性 | |
| D. | 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
分析 A.依据盐类水解应用解答;
B.光导纤维主要成分二氧化硅;
C.依据浓硫酸的吸水性解答;
D.依据液态氨气汽化吸收热量具有制冷作用解答.
解答 解:A.FeCl3易溶于水,电离产生的三价铁离子水解生成氢氧化铁胶体,具有吸附性,能够吸附水中固体杂质颗粒,可用作净水剂,故A正确;
B.二氧化硅具有良好的光学特性,为光导纤维主要成分,故B错误;
C.浓硫酸具有吸水性,常用于干燥剂,浓硫酸能干燥氯气,故C正确;
D.氨易液化,液氨气化吸收大量的热,具有制冷作用,所以液氨常用作制冷剂,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查元素化合物的用途,明确相关物质的性质是解题关键,注意硅与二氧化硅性质用途的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
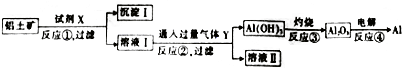
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期及中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等:M 是地壳中含虽最多的金属元素.请用化学用语填空..
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期及中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等:M 是地壳中含虽最多的金属元素.请用化学用语填空..| J | ||||
| R |
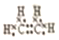 .
.| 选项 | A | B | C | D |
| M | 温度 | 温度 | H2的物质的量 | 甲的物质的量 |
| N | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
| 甲转化为HLO3的情况 | X取值范围 | N(HLO3)y/mol |
| 无HLO3的生成 | y=0 | |
| 有部分HLO3的生成 | ||
| 全部生成HLO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向装有Fe(NO3)2溶液的试符中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2 | |
| B. | 高温下用焦炭还原SiO2制取粗硅 | |
| C. | Na2O2用作呼吸面具的供氧裒剂涉及氧化还原反应 | |
| D. | 浓硝酸有强氧化性,常温下能与Fe发生剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置制取少量Cl2 | B. | 用图2所示装置制取干燥的NH3 | ||
| C. | 用图3制备并检验H2的可燃性 | D. | 用图4装置鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com