
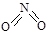 和
和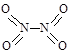 。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。 N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )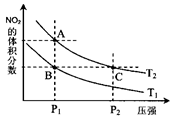
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
 N2O4(g)该反应的平衡常数K的值为 ;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4(g)该反应的平衡常数K的值为 ;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.565kJ | B.282.5kJ | C.765kJ | D.380kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
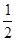 O2(g)
O2(g)  SO3(g) ΔH="-98.32" kJ·mol-1,在容器中充入 2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH="-98.32" kJ·mol-1,在容器中充入 2 mol SO2和1 mol O2充分反应,最终放出的热量为( )| A.196.64 kJ | B.196.64 kJ | C.<196.64 kJ | D.>196.64 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
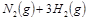
 2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题:
2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 L液态水分解成2L氢气与1L氧气吸收571.6kJ热量 |
| B.2 mol氢气与1mol氧气反应生成2mol气态水放出热量大于571.6kJ |
| C.在相同条件下,2 mol氢气与1mol氧气的能量总和大于2mol液态水的能量 |
| D.使用催化剂能降低该反应的活化能使反应放出得热量小于571.6kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
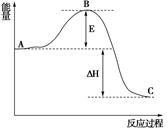
 。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH +HCI |
| B.NaOH( aq)+HC1( aq) |
| C.NaOH(1)+HCl(1) |
| D.NaOH( aq)+HCl( aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com