
����Ŀ��A��B��C��DΪ���ֵ��ʣ�����ʱ��A��B�����壬C��D�ǹ��壮E��F��G��H��IΪ���ֻ����F����ˮ��EΪ�����Ҽ�����ˮ��Ϊ��ɫ��Һ��G����ˮ�û���ɫ��Һ����������ʼ䷴Ӧ��ת����ϵ��ͼ��ʾ 
��1��д�����ֵ��ʵĻ�ѧʽ ABCD
��2��д��H+B��G�����ӷ���ʽ��
��3��д��G+I��H+D+E�Ļ�ѧ����ʽ��
��4��ij������B��Ư�ۣ� ��д����Ư�۵Ļ�ѧ����ʽ ��
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ij��С�����������ʵ�飺��ȡƯ��3.0g����ĥ���ܽ⣬���ó�250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ���������ᣨ��ʱ���������ӷ���ʽΪ���������ã�����ȫ��Ӧ����0.2molL��1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷֵ���������Ϊ������С�������λ����
���𰸡�
��1��H2��Cl2��Fe��S
��2��2Fe2++Cl2=2Fe3++2Cl��
��3��2FeCl3+H2S=2FeCl2+S��+2HCl
��4��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��2H++2I��+ClO��=I2+Cl��+H2O��47.67%
���������⣺A��B��C��DΪ���ֵ��ʣ�����ʱ��A��B�����壬C��D�ǹ��壬E��F��G��H��IΪ���ֻ����G����ˮ�û���ɫ��Һ����G�к������ӣ���Ԫ���غ��֪��CΪFe��F������ˮ��FΪFeS��DΪS��EΪ�����Ҽ�������ˮ��Ϊ��ɫ��Һ����EΪHCl��HCl��Fe��Ӧ������������AΪH2 �� BΪCl2 �� GΪFeCl3 �� HΪFeCl2 �� IΪH2S��G��I��Ӧ����FeCl2��S��HCl����1��������������֪��AΪH2 �� BΪCl2 �� CΪFe��DΪS�����Դ��ǣ�H2��Cl2��Fe�� S����2����FeCl2��������Ӧ����FeCl3 �����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl�� �� ���Դ��ǣ�2Fe2++Cl2=2Fe3++2Cl������3��FeCl3��H2S��Ӧ����FeCl2��S��HCl�����ݵ�ʧ�����غ㡢ԭ���غ���ƽ����Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+H2S=2FeCl2+S��+2HCl�� ���Դ��ǣ�2FeCl3+H2S=2FeCl2+S��+2HCl����4���ٹ�ҵ����������ʯ���鷴Ӧ��ȡƯ�ۣ���ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O�����Դ��ǣ�2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O����Ư���е�ClO�����������ԣ�I�����л�ԭ�ԣ���������Һ�з���������ԭ��Ӧ������I2��Cl����ˮ���ٸ��ݵ�ʧ�����غ㡢ԭ���غ���ƽ����Ӧ�����ӷ���ʽΪ��2H++2I��+ClO��=I2+Cl��+H2O�����������KI��Һ������������Ư����Һ��Ӧ����2H++2I��+ClO��=I2+Cl��+H2O����2Na2S2O3+I2=Na2S4O6+2NaI���ù�ϵʽCa��ClO��2��2Cl2��2I2��4Na2S2O3 ��
n[Ca��ClO��2]= ![]() n��Na2S2O3��=[20.0mL��10��3 LmL��1��0.2molL��1��
n��Na2S2O3��=[20.0mL��10��3 LmL��1��0.2molL��1�� ![]() ]��
]�� ![]() =0.01mol�����Ư������Ч�ɷֵ���������=
=0.01mol�����Ư������Ч�ɷֵ���������= ![]() ��100%=47.67%�����Դ��ǣ�2H++2I��+ClO��=I2+Cl��+H2O��47.67%��
��100%=47.67%�����Դ��ǣ�2H++2I��+ClO��=I2+Cl��+H2O��47.67%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij����X�������о������ʵ�װ�ã� 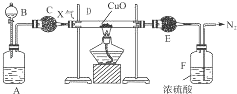
A��ʢ���ܵİ�ɫ���壬B��ʢ����ɫ�ӷ���Һ�壬C��E��ʢ�и������A��B����������ʱ����ɫ����X���ɣ�����ͼ��һϵ��װ����ĩ�˵õ�N2 �� ��E�ܵ��������ӣ�
��1��д��ʢ���Լ������ƣ� A�� �� B�� �� C�� �� E�� ��
��2��A��B��������������X����Ҫԭ���ǣ� ��
��3��D�з�Ӧ�Ļ�ѧ����ʽ ��
��4��F�з�Ӧ�Ļ�ѧ����ʽ ��
��5����D�з�Ӧ˵������X����������ԡ������ԡ��������ԡ���ԭ�ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ת��������AΪ����������CΪ�

�Իش�
��1��д��F�Ļ�ѧʽ________��H�Ļ�ѧʽ___________________________________��
��2��д����Eת���F�Ļ�ѧ����ʽ��________________________________��
��3����G��Һ����A���йط�Ӧ���ӷ���ʽ��________________________________________��
��4��д��A��һ����������ˮ��Ӧ�Ļ�ѧ����ʽ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��������������������ε��ǣ� ��
A.Na2SO4B.Ca(NO3)2C.NaNO3D.CH3COONa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£� �ٸ������ù�����̼��ԭ���������Ƶôֹ裬ͬʱ�õ�һ�ֿ�ȼ�����壻
�ڴֹ�������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2����
SiHCl3+H2����
��SiHCl3�������H2��1 100��1 200����¶��·�Ӧ�Ƶô��裬��֪SiHCl3����ˮ���ҷ�Ӧ���ڿ���������ȼ��
��ش�
��1����һ����ȡ�ֹ�Ļ�ѧ��Ӧ����ʽΪ ��
��2���ֹ���HCl���巴Ӧ��ȫ�������õ���SiHCl3���е�33.0�棩�к�������SiCl4���е�57.6�棩��HCl���е㩁84.7�棩���ᴿSiHCl3���õķ���Ϊ ��
��3��ʵ������SiHCl3�������H2��Ӧ��ȡ����װ����ͼ��ʾ�����Ⱥͼг�װ����ȥ���� 
��װ��B�е��Լ��� �� װ��C�е��ձ���Ҫ���ȣ�Ŀ���� ��
�ڷ�Ӧһ��ʱ���װ��D�й۲쵽�������� �� װ��D���ܲ�����ͨ�����ܵ�ԭ���� �� װ��D�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�1���ˮ�ܽ�700���������������Һ�ܶ�Ϊ0.9gcm��3 �� ���ְ�ˮ�����ʵ���Ũ�Ⱥ����ʵ����������ֱ�Ϊ�� ��
A.18.4molL��134.7%
B.20.4molL��138.5%q2
C.18.4molL��138.5%
D.20.4molL��134.7%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������۾����ɾۼ���ϩ��������(HEMA)�Ƴɳ�����Ƭ����ϳ�·�߿����ǣ�
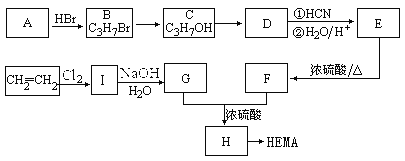
��֪���� 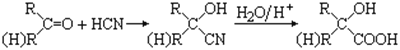
�� CH3COOCH2CH2OH������������������
�����
��1��A��D��E�Ľṹ��ʽ�ֱ�Ϊ��
A______________________��D_______________________��E______________________��
��2��д�����з�Ӧ�ķ�Ӧ���ͣ�C��D___________________��E��F__________________��
��3��д������ת���Ļ�ѧ����ʽ��
I��G________________________________________________________________________��
H��HEMA___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G��һ�ֳ����İ����ᣬ��ϳ�·����ͼ:
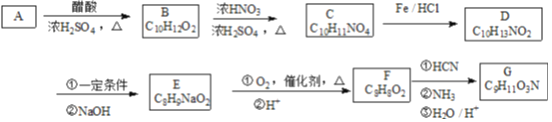
��֪������Ϣ:
��A������ֻ��1��ȡ�����Һ˴Ź���������6��壬�����֮��Ϊ1:2:2:2:2:1��D��F�ı����ϵ�һ�ȴ��ﶼֻ��2�֣�
��F��G����FeCl3��Һ������ɫ��Ӧ��F�ܷ���������Ӧ��
��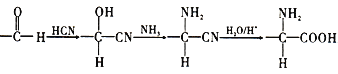 ��
��
�ش���������:
��1��B������Ϊ____________��
��2��F��G�Ĺ����Тٵķ�Ӧ������____________��
��3��B��C ��Ӧ�Ļ�ѧ����ʽΪ____________��
��4��G�Ľṹ��ʽΪ____________��
��5��F���б������ܷ���ˮ�ⷴӦ��ͬ���칹����____�֣����к˴Ź���������4�M�壬�����֮��Ϊ3:2:2:1����____________��
��6�����ձ����еĺϳ�·�ߣ�������ϩΪԭ�ϣ��ϳɱ�����(![]() )��д���ϳ�·�ߵ�����ͼ(���Լ�����ѡ) ________���ϳ�����ͼʾ������:
)��д���ϳ�·�ߵ�����ͼ(���Լ�����ѡ) ________���ϳ�����ͼʾ������:![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���������Ȥ�ı��ŷ�ʽ����ͬѧ��������Ԫ�ذ���ԭ������������˳��������еõ���ͼ��ʾ�ġ���ţ��Ԫ�����ڱ���ͼ��ÿ������������һ��Ԫ�أ�ͼ����ĸ����ʾԪ�ط��ţ�������˵����ȷ����

A. YԪ�ص��⻯������ȶ��Ա�ZԪ�ص��⻯���
B. K��Z��Ԫ�ص��⻯���ˮ��Һ��������
C. L��M��X��Ԫ��λ��ͬһ��
D. K��L��X��Z����Ԫ�����Ӱ뾶��С˳����Z����L+��X3+��K3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com