
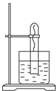
 如图所示,在大试管里固定一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置一周后,观察到铁丝发生的变化是
如图所示,在大试管里固定一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置一周后,观察到铁丝发生的变化是| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省吉林一中高二4月月考化学试卷(带解析) 题型:填空题
Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是____________________.试管里的水面会上升,最终上升高度约为_______,原因是_________________________________________________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.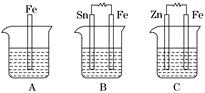
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二4月月考化学试卷(解析版) 题型:填空题
Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是____________________.试管里的水面会上升,最终上升高度约为_______,原因是_________________________________________________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
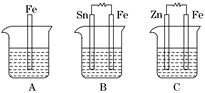
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com