
����Ŀ������ͼʾ���Ӧ��������ϵ��� (�� ��)
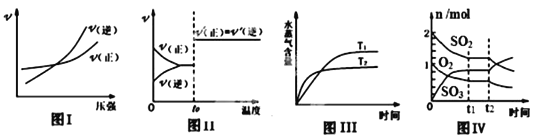
A. ͼ I����ӦN2+3H2![]() 2NH3�ں�������£���Ӧ������ѹǿ�Ĺ�ϵ
2NH3�ں�������£���Ӧ������ѹǿ�Ĺ�ϵ
B. ͼ��ӦH2+I2![]() 2HI��ƽ��������¶�ʱ��Ӧ������ʱ��ı仯
2HI��ƽ��������¶�ʱ��Ӧ������ʱ��ı仯
C. ͼ��ӦCO2(g)+H2(g) ![]() CO(g)��H2O(g) ��H>0��ˮ����������ʱ��ı仯
CO(g)��H2O(g) ��H>0��ˮ����������ʱ��ı仯
D. ͼ������Ӧ2SO2��O2![]() 2SO3��ƽ�����С������������ɷ����ʵ�����ʱ��ı仯
2SO3��ƽ�����С������������ɷ����ʵ�����ʱ��ı仯
���𰸡�D
��������
����A.����ѹǿ�������淴Ӧ���ʶ���������N2+3H2![]() 2NH3������Ӧ�����������С�ķ�Ӧ������ѹǿ����ѧƽ��������Ӧ��Ӧ�ƶ�������Ӧ����������࣬ͼ�����淴Ӧ����������࣬ƽ�������ƶ���ʵ�ʲ����������B.�����¶ȣ���ѧ��Ӧ���ʼӿ죬�����¶ȶ����ȷ�ӦӰ����������¶ȣ���ѧƽ�������ȵ��淴Ӧ�����ƶ������������ʱ仯����ȣ�ͼ��������������������ͬ�ı�������ʵ�ʲ����������C.��ͼ��֪���¶�T2 �ȵ���ƽ�⣬˵���¶ȣ�T2 ��T1 �������¶ȣ���ѧƽ�������ȵ�����Ӧ�����ƶ���ˮ�����ĺ�������ͼ�����¶�Խ�ߣ�ˮ�����ĺ���Խ�ͣ���ʵ�ʲ����������D.��С���������ʹ��ϵ��ѹǿ����ѧƽ�������������С������Ӧ�����ƶ���������������ʵ������������������������ʵ�����С��ͼ����ʵ������ϣ���ȷ��
2NH3������Ӧ�����������С�ķ�Ӧ������ѹǿ����ѧƽ��������Ӧ��Ӧ�ƶ�������Ӧ����������࣬ͼ�����淴Ӧ����������࣬ƽ�������ƶ���ʵ�ʲ����������B.�����¶ȣ���ѧ��Ӧ���ʼӿ죬�����¶ȶ����ȷ�ӦӰ����������¶ȣ���ѧƽ�������ȵ��淴Ӧ�����ƶ������������ʱ仯����ȣ�ͼ��������������������ͬ�ı�������ʵ�ʲ����������C.��ͼ��֪���¶�T2 �ȵ���ƽ�⣬˵���¶ȣ�T2 ��T1 �������¶ȣ���ѧƽ�������ȵ�����Ӧ�����ƶ���ˮ�����ĺ�������ͼ�����¶�Խ�ߣ�ˮ�����ĺ���Խ�ͣ���ʵ�ʲ����������D.��С���������ʹ��ϵ��ѹǿ����ѧƽ�������������С������Ӧ�����ƶ���������������ʵ������������������������ʵ�����С��ͼ����ʵ������ϣ���ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2��ȼ����Ϊ��H����285.8 kJ��mol��1��CO��ȼ����Ϊ��H����282.8 kJ��mol��1������H2��CO��ɵĻ������5.6 L(��״��)�������ȼ�պų�������Ϊ71.15 kJ��������Һ̬ˮ������˵����ȷ����
A. COȼ�յ��Ȼ�ѧ����ʽΪ2CO(g)��O2(g)===2CO2(g)����H����282.8 kJ��mol��1
B. H2ȼ�յ��Ȼ�ѧ����ʽΪ2H2(g)��O2(g)===2H2O(g)����H����571.6 kJ��mol��1
C. ȼ��ǰ���������CO���������Ϊ60%
D. ȼ�պ�IJ���ȫ���������Ĺ����������ÿɲ���0.125 mol O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ����ᴿ�����漰��������Ӧ����Ϊ��
��1��Ni(s)+4CO(g)![]() Ni(CO)4(g) ��H < 0 ��2��Ni(CO)4(g)
Ni(CO)4(g) ��H < 0 ��2��Ni(CO)4(g) ![]() Ni(s)+4CO(g)������˵����ȷ����
Ni(s)+4CO(g)������˵����ȷ����
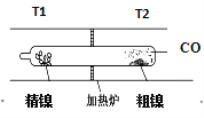
A. T1<T2
B. ��ͨ����ѹ�ķ�ʽ��߷�Ӧ��1����Ni(CO4)�IJ���
C. ��Ӧ��2��ƽ������¶ȣ�COŨ�ȼ�С
D. ���£���Ӧ��1��������ƽ����Է�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��Cu������ػ�������;�dz��㷺���ش��������⣺
��1����̬ͭԭ�ӵļ۵����Ų�ʽΪ__________________��
��2��ͭ��ش���ͬ������������������ͬ��ͭ���۷е㼰Ӳ�Ⱦ��ȼش���ԭ����___________________________��
��3��NH3���ӵ����幹��Ϊ_________������ԭ�ӵ��ӻ�������_________��
��4��N��S��P����ɵ����ʵij���Ԫ�ء�����Ԫ���е�һ������������_________���縺����С����_________��(��Ԫ�ط���)
��5����֪��Cu2O�۵�Ϊ1235�棬CuCl�۵�Ϊ426��������ж�Cu2OΪ_________ (�������Ӿ������������Ӿ���������ͬ)��CuClΪ_________��
(6)����ͭ�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ��
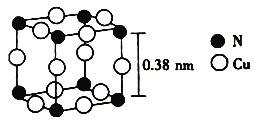
��ÿ��Cuԭ�ӽ��ڵ�Cuԭ����_________���������ӵ���������ֵΪNA���þ�����ܶ�Ϊ_________ (�г�����ʽ)g��cm��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����������H+��Na+��Al3+��Ba2+��OH-��Cl-��HCO3-�����е�������ɵ���Һ�����Է�����ͼת��������˵����ȷ����
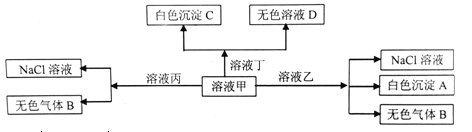
A. ��ΪHCl����ΪNaHCO3
B. ��Һ���л����Դ�������������У�Fe2+��NO3-��SO42-
C. �ڼ��еμӶ���ʼ��Ӧ�����ӷ���ʽ��HCO3-+Ba2++OH-=BaCO3��+H2O
D. ��ɫ����A�����ܽ�����ҺD��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ�ָ�Ч������ɱ����Ư�����������������£�

��1��NaClO2����Ԫ�صĻ��ϼ���_________����������ԭ�Ƕ��Ʋ�NaClO2���ܾ��еĻ�ѧ������_________��
��2������I����������Cl2���ɡ�
�� Cl2�Ĵ��ڻ���ɲ�Ʒ�к���NaCl���������ӷ���ʽ������ԭ��_________��
�� ���������Ϣ�������ʵ�鷽����ȥClO2�е�Cl2 ________��
ClO2 | Cl2 | |
��ˮ�е��ܽ��� | ���� | �� |
��CCl4�е��ܽ��� | ���� | �� |
��3������II��H2O2��������________�������������ԭ��������
��4��������ÿ����1 mol NaClO2������SO2�������________L����״���£���
��5����֪��
i. ѹǿԽ�����ʵķе�Խ�ߡ�
ii. NaClO2������Һ���¶ȵ���38��ʱ����NaClO23H2O
38~60��ʱ����NaClO2����
����60��ʱ�ֽ��NaClO3��NaCl
�� ����III���á���ѹ������������ԭ����_____��
�� �뽫����III�IJ�����������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����373Kʱ����0.5mol N2O4����ͨ�����Ϊ5L�ĺ����ܱ�������,�������ֺ���ɫ����Ӧ���е�2��ʱ,NO2��Ũ��Ϊ0.02 mol/L����60��ʱ,��ϵ�Ѵ�ƽ��,��ʱ������ѹǿΪ��ʼʱ��1.6��������˵����ȷ���ǣ� ��
A. ǰ2�룬��N2O4��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol/(L��s)
B. ��2��ʱ��ϵ�ڵ�ѹǿΪ��ʼʱ��1.2��
C. ��ƽ��ʱ��ϵ�ں�N2O40.20mol
D. ƽ��ʱ������ٳ���һ����N2O4, ������N2O4��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��8��12�������ش�ը�¹ʣ���һ�����������ǶԻ�������Ĺ�ע���ݲ�Σ���ֿ��д��д������ơ��ء����ף�P4��������狀��軯�ƣ�NaCN����
��1�������ж��ܺ�������Һ����������ԭ��Ӧ��3P4+10HClO3+18H2O=10HCl+12H3PO4���÷�Ӧ������������ ������1 mol P4�μӷ�Ӧת�Ƶ���Ϊ mol��
��2���軯�ƣ�NaCN����һ�ֻ���ԭ�ϣ����ڻ�����ѧ�ϳɡ���ơ�ұ����л��ϳ�ҽҩ��ũҩ�����������ȷ��档
����֪��25��ʱ��HCN�ĵ���ƽ�ⳣ��Ka=6.2��10-10��H2CO3��25��ʱ�ĵ���ƽ�ⳣ����Ka1= 4.5��10-7��Ka2= 4.7��10-11������NaCN��Һͨ������CO2��Ӧ����ʽ�ǣ� ��
�������£��軯���������������Һ��Ӧ������̼�����ƺ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬����䶾�ԡ��÷�Ӧ�Ļ�ѧ����ʽ�ǣ� ��
����ⷨ���Դ��������еĵ������������ͼʾ���أ���NOx�ڵ����зֽ������Ⱦ��N2��O2��ȥ�����缫���ǹ������������ʣ���һ�������¿����ɴ���O2-������������ӦΪ ��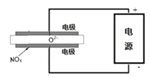
��3������ͳ��ҵ�����ð������Ժϳ����ء���Ҫ��Ӧ���£�
2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H= ��159.47 kJ��mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ��H=" +72.49" kJ��mol-1
��Ӧ2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(g)����H= kJ��mol-1
����ҵ���ð����Ʊ����ᣬ��һ��������ͭ�ۼ��뵽100mLijŨ�ȵ�ϡ�����г�ַ�Ӧ��������ʣ��m1gͭ�ۣ���ʱ���ռ���NO����448mL����״������Ȼ��������������м���ϡ���������ٲ���NOΪֹ������ʣ��ͭ��m2g����m1��m2Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ҫ���л��ϳ��м��壬��һ�ֺϳ�·�����£�
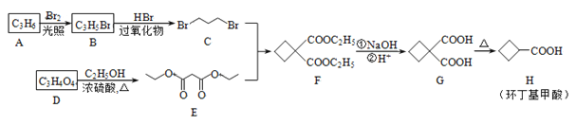
�ش��������⣺
��1��A����ϩ������ṹ��ʽΪ____________________��
��2��B��C�ķ�Ӧ������_________________���÷�Ӧ���ɵ���C��Ϊͬ���칹��ĸ�������__________________��д�ṹ��ʽ����
��3��E�Ļ�ѧ������___________________________��
��4��д��D����E�Ļ�ѧ����ʽ_______________________________________________��
��5��H��һ��ͬ���칹��Ϊ��ϩ��������CH2��CH��COOC2H5����д���۱�ϩ��������NaOH��Һ��ˮ��Ļ�ѧ����ʽ_________________________________________________________��
��6��д��ͬʱ��������������G������ͬ���칹��__________________________________��
��д�ṹ��ʽ�������������칹����
�ٺ˴Ź�������Ϊ3����� ����ʹ������Ȼ�̼��Һ��ɫ��
��1mol��ͬ���칹������������NaHCO3��Ӧ����88g���塣
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com