
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Ba2+、HCO3-、Cl- | |
| C. | pH=7的溶液:Fe3+、K+、SO42-、Br- | |
| D. | 0.1mol/LNaAlO2溶液:Al3+、Na+、SO42-、Cl- |
分析 A.使甲基橙变红色的溶液呈酸性;
B.使酚酞变红色的溶液呈碱性;
C.Fe3+水解呈酸性,只能稳定存在于酸性溶液中;
D.与AlO2-反应的离子不能大量共存.
解答 解:A.使甲基橙变红色的溶液呈酸性,酸性条件下离子之间不发生任何反应,故A正确;
B.使酚酞变红色的溶液呈碱性,碱性条件下HCO3-不能大量存在,故B错误;
C.Fe3+水解呈酸性,只能稳定存在于酸性溶液中,不可能存在于pH=7的溶液中,故C错误;
D.Al3+与AlO2-发生互促水解反应而不能大量共存,故D错误.
故选A.
点评 本题考查离子共存,为高频考点,侧重考查复分解反应、水解反应,题目综合考查元素化合物知识,为高考高频点,明确离子共存条件及离子性质即可解答,易错选项是D.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
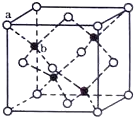 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 通过煤的液化得到水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol N2所含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 | |
| D. | 1mol•L-1的盐酸中氯离子为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
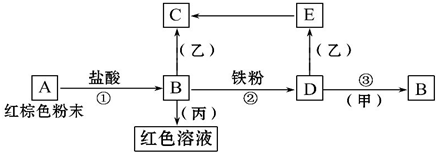 下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.
下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向新制的氯水中加KI?淀粉溶液即可证明 | |
| B. | 向久置失效的氯水中加KI?淀粉溶液即可证明 | |
| C. | 直接观察氯水溶液仍显黄绿色即可说明,不需进一步实验 | |
| D. | 用实验证明干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com