
【题目】能产生丁达尔效应的是
A. 酒精 B. CuSO4溶液 C. Fe(OH)3胶体 D. 生理盐水
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
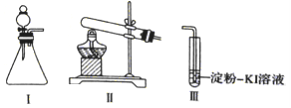
供选试剂:30%H2O2溶液、0.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向I的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理、操作规范的是( )
A.
灼烧
B.
过滤
C.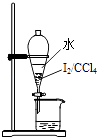
分液
D.
蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解制得A。以A为原料制取有机玻璃N及隐形眼镜材料M的合成路线如下:
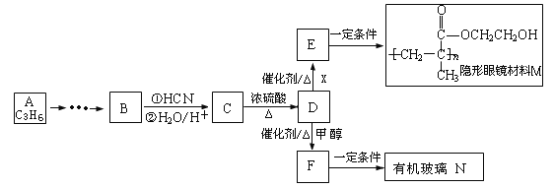
已知: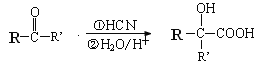 (-R,-R’为可能相同或可能不同的原子或原子团)
(-R,-R’为可能相同或可能不同的原子或原子团)
请回答:
(1)A中官能团的名称是_______,B的结构简式是______。
(2)F→N反应的化学方程式是________,反应类型是________。
(3)C在一定条件下转化为高分子化合物的化学方程式是________。
(4)D有多种同分异构体,符合下列条件的有____种(包括顺反异构体)。
①能发生银镜反应 ②能与NaOH溶液反应
(5)B是一种重要的工业溶剂,请完成A→B的反应的合成路线(有机物写结构简式、无机试剂任选):___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对 空气与地面进行消毒.
(1)配制 220mL0.05mol/L 的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒胶头滴管及
(2)配制过程中,可能引起浓度偏高的操作有 ;
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)下列叙述正确的是 (填字母)
A.可用过滤的方法将过氧乙酸溶液中混有的 NaCl 除掉
B.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
C.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(4)过氧乙酸半小时内会完全分解生成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是
(5)如果生产过氧乙酸的原料 CH3COONa 中混有了 SO42﹣ , 要想除掉 SO42﹣请选择下列试剂按照加入先后顺序填空(试剂不必选完,填序号即可)
①盐酸 ②醋酸钡溶液 ③氯化钡溶液 ④醋酸 ⑤碳酸钠溶液 ⑥碳酸氢钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的废料(含MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备MnO2,实现锰的再生利用。其工艺流程如下:
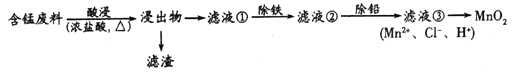
已知:①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
②金属离子(起始浓度为0.1 mol·L-1)生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
回答下列问题:
(1)酸浸过程中MnO2与浓盐酸反应的离子方程式为_____________________________。
(2)滤液①中铁以Fe3+存在,Fe2+转化为Fe3+过程中,可能发生反应的离子方程式为____________________(写出1种即可)。
(3)除铁的方法是:向滤液①中加MnCO3调节溶液pH,其范围是______________________;过滤得滤液②。
(4)将滤液③转化为MnO2的方法常用氧化法和电解法。
①氧化法的具体做法是向所得溶液中加入酸化的NaC1O3将Mn2+氧化为MnO2,该反应的离子方程式为_____________________________________。
②电解法生成MnO2的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子晶体的叙述错误的是( )
A.原子晶体中,原子不遵循紧密堆积原理B.原子晶体具有空间网状结构
C.原子晶体中不存在独立的分子D.原子晶体熔化时不破坏共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的钠铝合金置于水中,合金全部溶解,得到 20mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示:
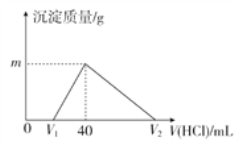
写出有关反应的化学方程式:
(1)______________________________ ;(2)______________________________;
(3)______________________________ ;(4)____________________________ ;
(5)____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com