
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 用惰性电极电解1 L 1mol/L CuSO4溶液,阴极得到的铜原子的数目一定为NA
B. 将2.3g钠投入到100ml 0.8mol/L的稀盐酸中,完全反应后可得到H2的数目为0.01NA
C. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
科目:高中化学 来源: 题型:
【题目】构成月季和孔雀的主要化学元素有
A.C、H、O、S、N、PB.C、H、O、N、P、Fe
C.N、P、K、Ca、S、ZnD.H、O、K、S、P、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,一个充满Cl2的恒容密闭容器的质量为74.6 g,若改充满N2,其质量为66 g,则容器的容积为:
A.5.6LB.11.2LC.2.24LD.4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
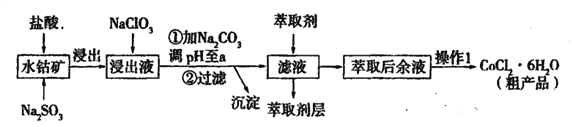
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室需配制100mL2 mol/LNaOH溶液,请回答下列问题
(1)配制过程中不需要使用的化学仪器有_______(填选项的字母)。
A.烧杯. B.100mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒
(2)用托盘天平称取所需氢氧化钠固体,质量为______g。
Ⅱ.某校化学兴趣小组利用右图装置来制取氨气
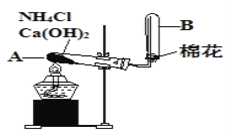
(1)写出用此方法制NH3的化学反应方程式___________________。
(2)图中收集氨气的方法为___________。
(3)若将有浓盐酸的玻璃棒靠近收集氨气的导管口,能观察到的实验现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气反应的有关热化学方程式如下,下列说法正确的是
① I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 kJ·mol–1
2HI(g) △H=-9.48 kJ·mol–1
② I2(s)+H2(g) ![]() 2HI(g) △H=+26.48 kJ·mol–1
2HI(g) △H=+26.48 kJ·mol–1
A.①的产物比②的产物稳定
B.②的反应物总能量比①的反应物总能量低
C.I2(s) ![]() I2(g) △H=+17.00 kJ·mol–1
I2(g) △H=+17.00 kJ·mol–1
D.在装有1mol I2(g)的密闭容器中通入1 mol H2(g),发生反应时放热9.48 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、SO42—、NH4+、CO32—、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有____,可能存在的离子有______;
(2)原溶液中c(CO32—)为____,c(NH4+)____c(SO42—) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl)__c(SO42—) (填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如下图所示:
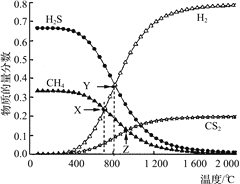
下列说法正确的是( )
A. 该反应的ΔH<0
B. X点CH4的转化率为20%
C. X点与Y点容器内压强比为51∶55
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1 mol时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存与发展的重要物质基础。
(1)普通玻璃的主要成分是Na2SiO3、CaSiO3和___(填化学式)。用于汽车或火车车窗的玻璃是___玻璃。
(2)在复合材料由两部分组成,,一部分作___,另一部分作______,如_____就是一种复合材料。
(3)硅酸盐水泥的主要成分是_______, 为调节水泥的硬化速度,常在水泥中加入___。
(4)工业上制水泥和玻璃需用到的共同原料是______,制水泥和陶瓷需用到的共同原料是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com