
| A. | 用加热蒸发K2CO3溶液的方法获得K2CO3晶体 | |
| B. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| C. | 用Na2S溶液和CuSO4溶液反应无法制取CuS固体 | |
| D. | 加热MgCl2溶液制取MgCl2固体 |
分析 A.碳酸钾受热稳定;
B.硫离子和铝离子发生双水解反应生成氢氧化铝沉淀和硫化氢气体;制取硫化铝固体,不能用铝盐和硫化物来制取,可以采用干法;
C.硫化铜为黑色沉淀;
D.氯化镁结晶水合物加热过程中镁离子是弱碱阳离子易水解.
解答 解:A.碳酸钾受热稳定,可蒸发得到碳酸钾,故A正确;
B.硫离子和铝离子发生双水解反应生成氢氧化铝沉淀和硫化氢气体,反应的离子方程式为:2Al3++3S2-+6H2O=3H2S↑+2Al(OH)3↓;无法制取硫化铝(Al2S3)固体,如果制取硫化铝固体,可以用金属铝和硫粉加热的方法来制取,故B错误;
C.硫化铜为黑色沉淀,可发生反应,故C错误;
D.氯化镁结晶水合物加热过程中镁离子是弱碱阳离子易水解生成氢氧化镁,MgCl2•6H2O制取无水氯化镁时需要在氯化氢气流的氛围下加热固体,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及盐类的水解、复分解反应等,侧重实验基本操作和实验原理的考查,注意实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
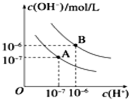 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2- Na+Mg2+Al3+ | B. | O Cl S P | ||
| C. | K+ Mg2+ Al3+ H+ | D. | A l3+Mg2+ Ca2+ F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的能量越低,运动区域离核越远 | |
| B. | 当M层是最外层时,最多可排布18个电子 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 核外电子的分层排布即是核外电子的分层运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新戊烷C(CH3)4 | B. | 3-乙基-1-丁烯 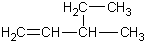 | ||
| C. | 2-甲基-2,4-己二烯  | D. | 2,2,3-三甲基戊烷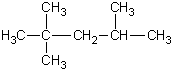 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
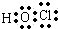 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 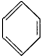 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$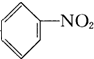 +H2O +H2O | B. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3-CH3 | ||
| C. | CH3-CH3+Cl2$\stackrel{光照}{→}$CH3-CH2Cl+HCl | D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
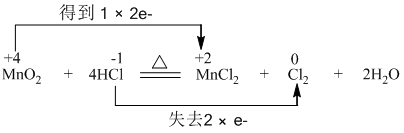
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| z | W | Q |
| A. | Y元素气态氢化物的稳定性大于X元素的气态氢化物 | |
| B. | 形成的简单离子半径:W>Q>Z>X | |
| C. | Q的最高价氧化物对应的水化物酸性最强 | |
| D. | X的最高价氧化物对应的水化物与其氢化物形成的化合物中含有离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com